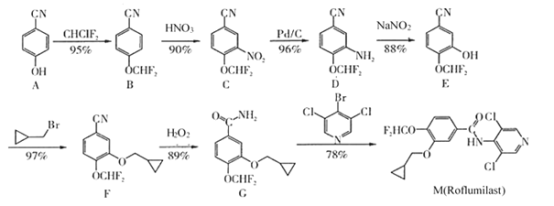
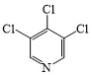
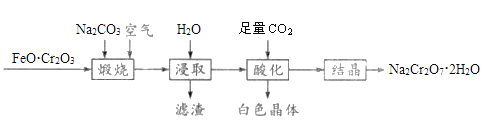
题目内容
【题目】中国古代陶瓷烧制工艺的珍品“唐三彩”中的蓝色,其釉料的着色剂是一种含钴矿物。钴在制取颜料和制备合金方面有着重要的应用,回答下列问题。
(1)基态Co2+的核外电子排布式为__________,基态Co原子中空间运动状态不同的电子数为___种。
(2)配合物[Co(NH3)5Br](NO3)2中存在的化学键类型有__________,配体NH3中配位原子的杂化轨道类型为__________,NO3-的空间构型是__________,第一电离能N__________(填“大于”或“小于”)O。
(3)CoO2具有如图所示的层状结构(小球表示Co,大球表示O)。下列用粗实线画出的结构单元不能描述其化学组成的是__________(填字时代号)。
A.  B.
B. 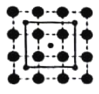 C.
C. 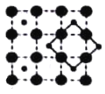 D.
D. 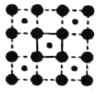
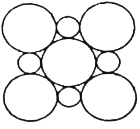
(4)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________ nm(结果保留三位小数,下同)。CoO也属于NaCl型结构,晶胞参数为a'=0.488 nm,则r(Co2+)为________ nm
【答案】1s22s22p63s23p63d7(或Ar[3d7]) 15 离子键、共价键、配位键 sp3 平面(正)三角形 大于 D 0.148 0.076
【解析】
(1)Co为第27号元素,Co2+的核外电子排布式为1s22s22p63s23p63d7(或Ar[3d7]),空间运动状态即核外电子占有的不同能级,Co的核外电子排布式为1s22s22p63s23p63d74s2,共有4个s能级,2个p能级,1个d能级,s能级一个形状,p能级3个形状,d能级5个形状,所以基态Co原子中空间运动状态不同的电子数为4+2×3+5=15;
(2)物质[Co(NH3)5Br](NO3)2为配位化合物,其存在的化学键类型有:共价键、离子键、配位键;配体NH3中中心原子为N原子,根据VSEPR模型计算,N原子周围有4个电子对,故N原子的杂化方式为sp3杂化;根据VSEPR模型计算,NO3-的空间构型为平面正三角形;氮元素的2p轨道电子处于半充满稳定状态,N元素的第一电离能大于O元素。
(3)根据粗实线所画的结构单元可以算出,A图中:每条粗实线上有1个O原子,这个氧原子属于两个结构单元,故一个结构单元中共有2个O原子和1个Co原子;B图中:两条粗实线的交点上有一个Co原子,这个Co原子被4个结构单元共有,故一个结构单元中有2个O原子和1个Co原子;C图中:两条粗实线的交点是Co原子,被4个结构单元共有,粗实线上有1个O原子,被两个结构单元公用,故一个结构单元中有2个O原子和1个Co原子;D图中两条粗实线的交点为O原子,被4个结构单元公用,结构单元中有1个Co原子,故一个结构单元中1个O原子和1个Co原子,故答案为D;
(4)MgO晶胞:大圆代表O2-,小圆代表Mg2+,晶胞参数为0.420nm,晶胞的面对角线长为![]() =0.594nm,对角线上是4个O2-的半径长度,故r(O2-)=0.148nm;CoO晶胞:CoO的晶胞参数为0.488nm,晶胞参数是由2个O2-半径和1和Co2+直径组成,故r(Co2+)=0.076nm。
=0.594nm,对角线上是4个O2-的半径长度,故r(O2-)=0.148nm;CoO晶胞:CoO的晶胞参数为0.488nm,晶胞参数是由2个O2-半径和1和Co2+直径组成,故r(Co2+)=0.076nm。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。