题目内容
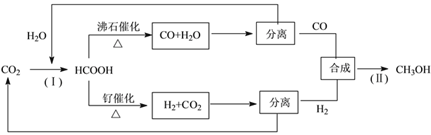
【题目】实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:

(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。

请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
【答案】 加快反应速率 FeO+2H+=Fe2++H2O; Fe2O3+6H+=2Fe3++3H2O; MgO+2H+ =Mg2++H2O;
Al2O3+6H+=2Al3++3H2O;若写 2Fe2++4H++MnO2=Mn2++2Fe3++2H2O 等合理答案也给分。 3MnO2+KC1O3+6KOH![]() 3K2MnO4+KCl+3H2O KC1O3自身会分解 b 至pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤
3K2MnO4+KCl+3H2O KC1O3自身会分解 b 至pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤
【解析】本题以软锰矿为原料,考查常见无机物质高锰酸钾的制备,仔细分析每一个流程中加入的物质、发生的反应,主要产物及杂质,根据所学的知识即可较好的解决。加入稀硫酸,可除去杂质FeO、Fe2O3、MgO和Al2O3,滤渣为MnO2,加入氯酸钾和氢氧化钾熔融可得到高锰酸钾固体,溶解得到溶液,然后高锰酸钾和杂质的溶解度的差异,可分离出高锰酸钾。
(1)向软锰矿中加入稀硫酸,能将杂质转化为溶于水的物质,从而将杂质除去,为了加快反应速率,可以采取升温、将软锰矿粉碎、加大硫酸浓度等措施。金属氧化物与酸反应的离子方程式为:FeO+2H+=Fe2++H2O; Fe2O3+6H+=2Fe3++3H2O; MgO+2H+ =Mg2++H2O;Al2O3+6H+=2Al3++3H2O;MnO2有氧化性,能与Fe2+ 发生:2Fe2++4H++MnO2=Mn2++2Fe3++2H2O 。故答案为:加快反应速率;离子方程式按上述任写一个。
(2) ①在KOH存在下,MnO2被KC1O3氧化成K2MnO4 ,KC1O3 被还原为KCl,发生的反应为: 3MnO2+KC1O3+6KOH![]() 3K2MnO4+KCl+3H2O 。 ② 加大一种反应物的用量,往往可以使另一种反应物的转化率提高,本题加入过量的KC1O3,可以太高MnO2的转化率,提高其利用率;高温下KC1O3自身会分解,降低MnO2利用率,故KC1O3要过量。答案为: KC1O3自身会分解 ③KOH为强碱,具有强腐蚀性,高温下腐蚀性更强,能与SiO2、Al2O3发生反应,故不能选用,只能用铁坩埚,答案选b。
3K2MnO4+KCl+3H2O 。 ② 加大一种反应物的用量,往往可以使另一种反应物的转化率提高,本题加入过量的KC1O3,可以太高MnO2的转化率,提高其利用率;高温下KC1O3自身会分解,降低MnO2利用率,故KC1O3要过量。答案为: KC1O3自身会分解 ③KOH为强碱,具有强腐蚀性,高温下腐蚀性更强,能与SiO2、Al2O3发生反应,故不能选用,只能用铁坩埚,答案选b。
(3)浸取液中含有K2MnO4及杂质KCl,相同温度下,KMnO4和K2CO3溶解度差异很大,所以缓慢通入CO2气体至溶液pH约为12.3,K2MnO4转化为KMnO4和固体MnO2,同时生成K2CO3,过滤得到滤液 KMnO4、 K2CO3 、KCl及其他少量杂质,相同温度下 K2CO3 、KCl及其他少量杂质溶解度大于KMnO4 ,故可将将滤液蒸发浓缩,冷却结晶到较低温度,过滤,洗涤就可得到较纯的KMnO4晶体,然后低温烘干即可。答案为:至pH≈12.3 ,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤