题目内容
【题目】Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应:![]() 。溶液中
。溶液中![]() 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
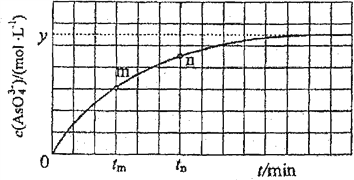
①下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(![]() )
)
C.![]() /
/![]() 不再变化
不再变化
d.c(I-)=2ymol·L-1
②tm时,V正________V逆(填“大于”“小于”或“等于”)。
③tm时V逆________tm时V逆(填“大于”“小于”或“等于”),理由是____________________________。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)________。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式__________________________
正极反应式__________________________

【答案】  2As2S3+5O2+6H2O=4H3AsO4+6S acd 大于 小于 tm时AsO43-浓度更小,反应速率更慢 CO(g)+2H2(g)
2As2S3+5O2+6H2O=4H3AsO4+6S acd 大于 小于 tm时AsO43-浓度更小,反应速率更慢 CO(g)+2H2(g)![]() CH3OH(g) 2CH3OH+3O2=2CO2+4H2O 3O2+12e-+12H+=6H2O
CH3OH(g) 2CH3OH+3O2=2CO2+4H2O 3O2+12e-+12H+=6H2O
【解析】Ⅰ.(1)As的原子序数是33,砷的原子结构示意图为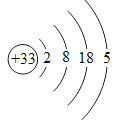 。(2)根据电子得失守恒和原子守恒可知As2S3与O2反应生成H3AsO4和单质硫的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S。(3)①a.溶液pH不变时,则c(OH-)也保持不变,反应处于平衡状态;b.根据速率关系,v(I-)/2=v(AsO33-),则v(I)=2v(AsO33-)始终成立,v(I)=2v(AsO33-)时反应不一定处于平衡状态;c.由于提供的Na3AsO3总量一定,所以c(AsO43-)/c(AsO33-)不再变化时,c(AsO43-)与c(AsO33-)也保持不变,反应处于平衡状态;d.平衡时c(I)=2c(AsO33-)=2×ymol/L=2ymol/L时反应是平衡状态,答案选acd。②反应从正反应开始进行,tm时反应继续正向进行,v正>v逆。③tm时AsO43-浓度更小,反应速率更慢,所以逆反应速率:tm<tn。
。(2)根据电子得失守恒和原子守恒可知As2S3与O2反应生成H3AsO4和单质硫的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S。(3)①a.溶液pH不变时,则c(OH-)也保持不变,反应处于平衡状态;b.根据速率关系,v(I-)/2=v(AsO33-),则v(I)=2v(AsO33-)始终成立,v(I)=2v(AsO33-)时反应不一定处于平衡状态;c.由于提供的Na3AsO3总量一定,所以c(AsO43-)/c(AsO33-)不再变化时,c(AsO43-)与c(AsO33-)也保持不变,反应处于平衡状态;d.平衡时c(I)=2c(AsO33-)=2×ymol/L=2ymol/L时反应是平衡状态,答案选acd。②反应从正反应开始进行,tm时反应继续正向进行,v正>v逆。③tm时AsO43-浓度更小,反应速率更慢,所以逆反应速率:tm<tn。
Ⅱ.(1)根据方程式CO2(g)+3H2(g)→CH3OH(g)+H2O(g)、CO(g)+2H2(g)→CH3OH(g)可知CO(g)+2H2(g)→CH3OH(g)更符合“绿色化学”理念。(2)负极甲醇失去电子发生氧化反应,正极氧气得到电子,发生还原反应,由于是酸性电解质溶液,所以正极反应式为3O2+12e-+12H+=6H2O,总反应式为2CH3OH+3O2=2CO2+4H2O。

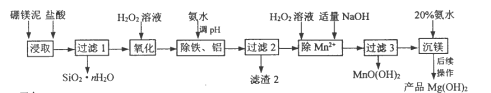
【题目】以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;
过滤3所得滤渣中含有MnO(OH)2和__________。
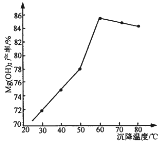
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。