题目内容
【题目】二氧化碳的捕捉、封存与再利用是实现温室气体减排的重要途径之一。
(1)二氧化碳的电子式为___________。
(2)下列利用二氧化碳的反应中原子利用率达100%的是_________(填序号)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.![]()
(3)一种正在开发的利用二氧化碳制取甲醇的流程如下:
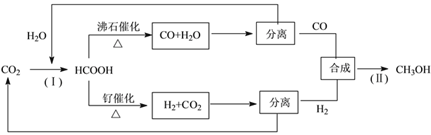
①反应(Ⅰ)将CO2和H2O转化为甲酸常用途径有两种,如下图(a)和(b)。
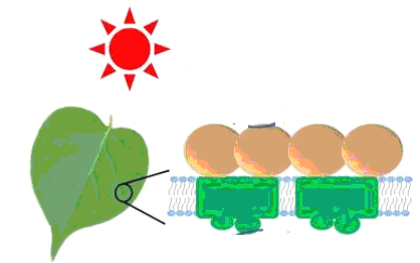
图(a)中能量主要转化方式为___________,图(b)中发生反应的化学方程式为___________。
②在5L的恒温恒容密闭容器中充入1moLCO和4molH2,加入催化剂发生反应,测得CO及CH3OH的物质的量随时间变化如下图所示。
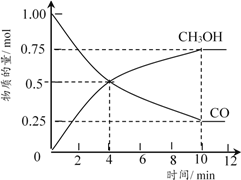
图中第___________min(填数字)反应达到平衡,CO在0~4min内的平均反应速率比在4~8min内的快,其原因是___________;达到平衡时氢气的浓度为___________。
【答案】 ![]() bd 光能转变为化学能 2CO2+2H2O
bd 光能转变为化学能 2CO2+2H2O![]() 2HCOOH + O2 10 随着反应的进行CO的浓度不断变小(或容器内气体的压强不断减小) 0.5mol·L-1
2HCOOH + O2 10 随着反应的进行CO的浓度不断变小(或容器内气体的压强不断减小) 0.5mol·L-1
【解析】(1)二氧化碳的电子式为![]() ;(2)b、d为加成反应和加聚反应,产物只有一种,二氧化碳在反应中原子利用率达100%,答案选bd;(3)①图(a)中能量主要转化方式为光能转变为化学能;根据图中信息可知,图(b)中发生反应为二氧化碳与水在通电作用下转化为甲醛和氧气,其化学方程式为:2CO2+2H2O
;(2)b、d为加成反应和加聚反应,产物只有一种,二氧化碳在反应中原子利用率达100%,答案选bd;(3)①图(a)中能量主要转化方式为光能转变为化学能;根据图中信息可知,图(b)中发生反应为二氧化碳与水在通电作用下转化为甲醛和氧气,其化学方程式为:2CO2+2H2O![]() 2HCOOH + O2;②根据图中信息可知,在第10min时各物质的量不再改变,反应达到平衡;随着反应的进行CO的浓度不断变小(或容器内气体的压强不断减小),CO在0~4min内的平均反应速率比在4~8min内的快;根据反应CO+2H2=CH3OH,达到平衡时CO由1mol降到0.25mol,则氢气由4mol应降到2.5mol,氢气的浓度为:
2HCOOH + O2;②根据图中信息可知,在第10min时各物质的量不再改变,反应达到平衡;随着反应的进行CO的浓度不断变小(或容器内气体的压强不断减小),CO在0~4min内的平均反应速率比在4~8min内的快;根据反应CO+2H2=CH3OH,达到平衡时CO由1mol降到0.25mol,则氢气由4mol应降到2.5mol,氢气的浓度为:![]() =0.5mol·L-1。
=0.5mol·L-1。

【题目】以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
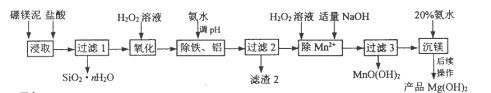
己知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为__________。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_________________________。
(3)“除铁、铝”时,需调节溶液pH范围为_________________________。
(4)“除Mn2+”时发生反应的离子方程式为_________________________;
过滤3所得滤渣中含有MnO(OH)2和__________。
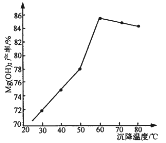
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。