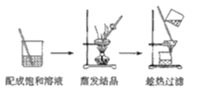
题目内容
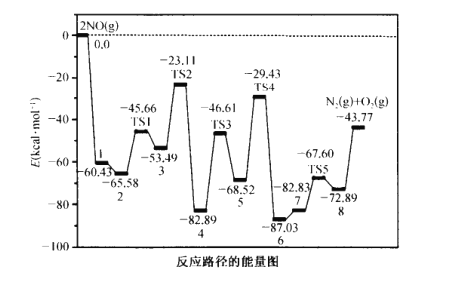
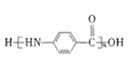
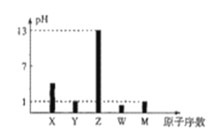
【题目】已知X、Y、Z、W、M均为短周期主族元素,X与W、M形成的化合物XW2、XM4均为重要的溶剂,25℃时,浓度均为0.1moL·L-1的上述元素的最高价氧化物对应的水化物溶液的pH随原子序数的变化如图所示.
回答下列问题:
(1)M在元素周期表中的位置为___________________.
(2)W可与Z形成化合物Z2W2,写出该物质的电子式:___________________________.
(3)写出一个能说明W与M非金属性强弱的离子方程式:__________________________.
(4)Z的单质可以与X的最高价氧化物反应生成一种盐和黑色固体单质,若每转移1mol电子,恢复至室温时该反应放出QkJ热量,写出该反应的热化学方程式:________________________________________.
(5)M的单质为有毒气体,且在工业上用途广泛,常用Y的简单氢化物检验其运输管道是否漏气,漏气时的现象为产生白烟,该反应中氧化剂与还原剂的物质的量之比为___________________.
【答案】第3周期第VIIA族 ![]()
![]()
![]() 3:2
3:2
【解析】
已知X、Y、Z、W、M均为短周期主族元素,25℃时,浓度均为0.1moL·L-1的上述元素的最高价氧化物对应的水化物溶液的pH随原子序数的变化如图所示,Z的最高价氧化物对应的水化物溶液的pH=13,说明其为一元强碱,则Z为Na元素;M的最高价氧化物对应的水化物溶液的pH=1,说明其为一元强酸,又M的原子序数大于Na,则M为Cl元素;W的最高价氧化物对应的水化物溶液的pH<1,又W的原子序数大于Na,小于Cl,说明其为硫酸,则W为S元素;X与W、M形成的化合物XW2、XM4均为重要的溶剂,则X为C元素;Y的最高价氧化物对应的水化物溶液的pH=1,说明其为一元强酸,又Y的原子序数大于C,小于Na,则Y为N元素,据此分析解答。
由以上分析知,X为C元素,Y为N元素,Z为Na元素,W为S元素,M为Cl元素,
(1)M为Cl元素,Cl在元素周期表中的位置为第3周期第VIIA族;
(2)Z为Na元素,W为S元素,S可与Na形成化合物过硫化钠Na2S2,类似Na2O2,该物质的电子式为:![]() ;
;
(3)向Na2S溶液中通入氯气,生成淡黄色沉淀,说明发生了反应![]() ,说明氧化性:Cl2>S,则非金属性:Cl>S;
,说明氧化性:Cl2>S,则非金属性:Cl>S;
(4)C的最高价氧化物为CO2,Na与CO2反应生成一种盐和黑色固体单质,应为Na2CO3和C单质,则反应的化学方程式为![]() ,当有4mol钠参与反应时转移4mol电子,若每转移1mol电子,恢复至室温时该反应放出QkJ热量,则4mol钠参与反应时,应放出4QkJ的热量,故该反应的热化学方程式:
,当有4mol钠参与反应时转移4mol电子,若每转移1mol电子,恢复至室温时该反应放出QkJ热量,则4mol钠参与反应时,应放出4QkJ的热量,故该反应的热化学方程式:![]() ;
;
(5)Cl2是有毒气体,常用NH3检验其运输管道是否漏气,漏气时的现象为产生白烟,发生反应的化学方程式为![]() ,根据化合价变化可知,当8molNH3和2mol氯气发生反应时,其中3mol氯气均得电子被还原,作氧化剂,而只有2molNH3中N元素失电子被氧化,作还原剂,另外6molNH3中N元素没有变价,故该反应中氧化剂与还原剂的物质的量之比为3:2。
,根据化合价变化可知,当8molNH3和2mol氯气发生反应时,其中3mol氯气均得电子被还原,作氧化剂,而只有2molNH3中N元素失电子被氧化,作还原剂,另外6molNH3中N元素没有变价,故该反应中氧化剂与还原剂的物质的量之比为3:2。

 阅读快车系列答案
阅读快车系列答案