题目内容
7. 如图表示配制 100mL 0.100ol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
如图表示配制 100mL 0.100ol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是容量瓶.
(2)步骤B通常称为转移,步骤A通常称为定容.
(3)将上述实验步骤A→F按实验过程先后次序排列CBDFAE.
(4)配制过程中出现以下情况,对溶液浓度有何影响(填“偏高”“偏低”“不变”)
①如果漏掉操作D偏低.
②操作A时俯视刻度线偏高.
③操作C时发现烧杯有水不变.
分析 (1)配制一定物质的量浓度溶液的仪器是容量瓶;
(2)用胶头滴管滴加溶液的操作名称是定容;
(3)根据配制溶液的实验操作过程进行实验步骤排序;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(1)配制一定物质的量浓度溶液的仪器是容量瓶,所以该仪器的名称是容量瓶,
故答案为:容量瓶;
(2)加水至液面距离刻度线1~2cm时,用胶头滴管向容量瓶中滴加溶液,该操作的名称是定容,
故答案为:定容;
(3)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,所以实验过程先后次序排列为:CBDFAE,
故答案为:CBDFAE;
(4)①如果漏掉操作D,则会导致溶质的损失,溶液浓度偏小,故答案为:偏低;
②操作A时俯视刻度线,则溶液体积偏小,浓度偏高,故答案为:偏高;
③操作C时发现烧杯有水,对溶液浓度无影响,故答案为:不变.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
18.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 浓度均为0.1 mol•L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO${\;}_{3}^{2-}$)<c(HCO${\;}_{3}^{-}$) | |
| C. | 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-) | |
| D. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
15.如图R、W、X、Y、Z为五种物质,若箭头表示能一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
| 选项 | R | W | X | Y | Z | 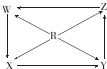 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl3 | FeCl3 | Fe(NO4)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO4)3 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
16.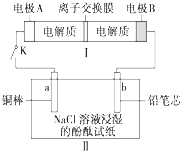 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
 如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为NaCl和酚酞和混合溶液浸湿的滤纸,离子交换膜只允许Na+通过,电池充电、放电的化学方程式为2Na2S2+NaBr3$\frac{\underline{\;放电\;}}{充电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 电池充电时,电极B连接直流电源的正极 | |
| B. | 电池放电过程中Na+从左到右通过离子交换膜 | |
| C. | 闭合开关K后,b电极附近pH变小 | |
| D. | 当b电极上析出气体1120mL(标准状况)时,有0.1 molNa+通过离子交换膜 |
17.某气体由氢气、一氧化碳、甲烷(CH4)中的-种或几种组成,点燃该气体后,将燃烧后的产物依次通过无水硫酸铜(无水硫酸铜遇水由白色变蓝色)和澄清石灰水,观察到无水硫酸铜铜变成蓝色,石灰水变浑浊.下列对气体组成的推断不正确是( )
| A. | 可能只有甲烷 | B. | 可能只有氢气 | ||
| C. | 可能是甲烷和一氧化碳 | D. | 可能3种气体都存在 |