题目内容
【题目】已知NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.CO2、CCl4中所有原子均达到最外层8电子稳定结构
B.18 g H2O和18 g D2O的质子数都为10NA
C.78 g Na2O2中所含离子的数目为4NA
D.KHSO4溶于水的过程中只有离子键断裂
【答案】A
【解析】
A.CO2分子中C元素化合价为+4,C原子最外层电子数是4,4+4=8,所以碳原子满足8电子稳定结构,O元素化合价为-2,O原子最外层电子数是6,6+2=8,C、O原子均满足8个电子稳定结构,CCl4中Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,所以氯原子满足8电子稳定结构,C元素化合价为+4,C原子最外层电子数为4,4+4=8,所以C、Cl原子均满足8个电子稳定结构,故A正确;
B.重水的摩尔质量为20g/mol,故18g重水和18g普通水的物质的量分别为0.9mol和1mol,而重水和普通水中均含10个质子,故0.9mol重水和1mol水中含有的质子数分别为9NA个和10NA个,故B错误;
C.78g Na2O2的物质的量为:![]() =1mol,1mol中Na2O2含有2mol钠离子和1mol过氧根离子,总共含有3mol离子,所含离子数目为3NA,故C错误;
=1mol,1mol中Na2O2含有2mol钠离子和1mol过氧根离子,总共含有3mol离子,所含离子数目为3NA,故C错误;
D.KHSO4溶于水,发生电离,产生钾离子、氢离子、硫酸根离子,则钾离子与硫酸氢根离子之间的离子键断裂,H、O之间的共价键断裂,故D错误;
答案为A。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
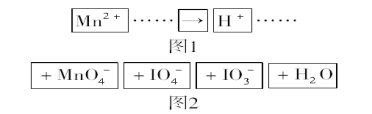
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
【题目】下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号 | A | B | C | D |
实验 方案 |
置于光亮处 |
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
A.AB.BC.CD.D
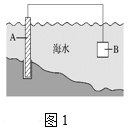
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。