题目内容
下列说法不正确的是( )
| A、常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) |
| B、将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多 |
| C、pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| D、0.2mol?L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.常温下,pH=7的溶液中c(OH-)=c(H+),再根据电荷守恒判断c(NH4+)、c(Cl-)相对大小;
B.加水稀释促进弱酸电离;
C.pH=13的溶液中c(OH-)=0.1mol/L,pH=1的醋酸中c(CH3COOH)>0.1mol/L,二者等体积混合时,醋酸过量,导致溶液呈酸性;
D.碳酸氢钠溶液中,HCO3-水解程度大于电离程度导致溶液呈碱性,但电离和水解程度都较小.
B.加水稀释促进弱酸电离;
C.pH=13的溶液中c(OH-)=0.1mol/L,pH=1的醋酸中c(CH3COOH)>0.1mol/L,二者等体积混合时,醋酸过量,导致溶液呈酸性;
D.碳酸氢钠溶液中,HCO3-水解程度大于电离程度导致溶液呈碱性,但电离和水解程度都较小.
解答:
解:A.常温下,pH=7的溶液中c(OH-)=c(H+),再根据电荷守恒得c(NH4+)=c(Cl-),故A错误;
B.加水稀释促进弱酸电离,所以要使pH相等的盐酸和醋酸稀释后溶液的pH仍然相等,醋酸加入水的量大于盐酸,故B正确;
C.pH=13的溶液中c(OH-)=0.1mol/L,pH=1的醋酸中c(CH3COOH)>0.1mol/L,二者等体积混合时,醋酸过量,导致溶液呈酸性,则pH<7,故C错误;
D.碳酸氢钠溶液中,HCO3-水解程度大于电离程度导致溶液呈碱性,但电离和水解程度都较小,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+),故D正确;
故选C.
B.加水稀释促进弱酸电离,所以要使pH相等的盐酸和醋酸稀释后溶液的pH仍然相等,醋酸加入水的量大于盐酸,故B正确;
C.pH=13的溶液中c(OH-)=0.1mol/L,pH=1的醋酸中c(CH3COOH)>0.1mol/L,二者等体积混合时,醋酸过量,导致溶液呈酸性,则pH<7,故C错误;
D.碳酸氢钠溶液中,HCO3-水解程度大于电离程度导致溶液呈碱性,但电离和水解程度都较小,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+),故D正确;
故选C.
点评:本题考查了弱电解质的电离、盐类水解等知识点,根据溶液中的溶质及溶液酸碱性再结合守恒思想分析解答,注意B可以采用逆向思维分析,为易错点.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
将浓硫酸敞口放置在空气中,其质量会□,浓度会□,在此过程中浓硫酸表现□性( )
| A、增大,减小,吸水性 |
| B、减小,增大,脱水性 |
| C、增大,增大,强还原性 |
| D、减小,减小,强氧化性 |
下列说法正确的是( )
| A、CO2分子的空间结构是直线形,故CO2分子是非极性分子 |
| B、分子CO和N2的原子总数相同,价电子总数相等,故性质相同 |
| C、Na+的电子排布式为1s22s22p63s1 |
| D、在元素周期表中,s区,d区和ds区的元素都是金属 |
用NA表示阿伏加德罗数,下列叙述正确的是( )
| A、7.8g Na2O2固体中阴、阳离子数之和一定为0.3NA |
| B、室温下,14.0g乙烯和丁烯的混合气体中含有的氢原子数目为NA |
| C、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D、常温常压下,1mol甲基所含的电子总数为7NA |
下列微粒中能影响水的电离平衡,且使水的电离平衡向左移动的是( )
| A、SO42- |
| B、Cl- |
| C、Na+ |
D、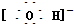 |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、pH=12的溶液中:NO3-、I-、Na+、ClO- |
| C、Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| D、c(H+)=1.0×10-13mol?L-1溶液中:CH3COO-、K+、SO42-、Br- |
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
| C、将某气体通入淀粉碘化钾溶液中,溶液变蓝,该气体一定是氯气 |
| D、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
一种氢镍电池的电极总反应是H2+2NiO(OH)═2Ni(OH)2,作为负极的是( )
| A、NiO(OH) |
| B、H2 |
| C、Ni |
| D、Ni(OH)2 |
