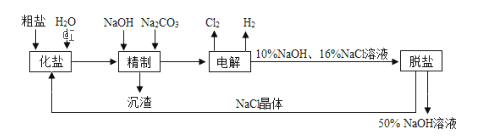
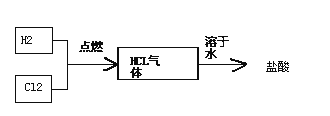
题目内容
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答。
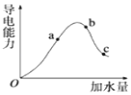
①a、b、c三点的氢离子浓度由小到大的顺序为______。
②a、b、c三点中,醋酸的电离程度最大的一点是______。
③测得某醋酸溶液中氢离子浓度为0.004molL﹣1,则醋酸的电离度为_____,该温度下醋酸的电离平衡常数K=_____。
【答案】c<a<b c 4% 1.6×10-5
【解析】
本题考查的是弱电解质在水溶液中的电离平衡。
①溶液的导电能力与离子浓度成正比;
②溶液越稀,醋酸的电离程度越大;
③电离度=已电离的醋酸/醋酸的总浓度×100%;醋酸的电离常数为Ka=c(CH3COO)c(H+)/c(CH3COOH)。据此解答。
①溶液的导电能力与离子浓度成正比,根据图象知,溶液导电能力大小顺序是b>a>c,则氢离子浓度由小到大顺序是c<a<b。本小题答案为:c<a<b。
②溶液越稀,醋酸的电离程度越大,根据图象知,溶液体积大小顺序是c>b>a,所以醋酸电离程度最大的是c。本小题答案为:c。
③醋酸溶液中氢离子浓度为0.004molL1,则醋酸的电离度=已电离的醋酸/醋酸的总浓度×100%=0.004/0.1×100%=4%
醋酸的电离常数为Ka=c(CH3COO)c(H+)/c(CH3COOH)=0.004×0.004/(0.10.004)=1.6×105。本小题答案为:4%;1.6×105。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目