题目内容
【题目】Ⅰ.据报道,日常生活中,将洁厕液与84消毒液混合使用会发生中毒的事故。
(1)84消毒液的主要成分是次氯酸钠,次氯酸钠与空气中CO2反应生成次氯酸,写出次氯酸钠的电子式:__________;若将84消毒液长期露置于空气中,溶液中的主要成分将变为__________(填化学式)。
(2)洁厕灵的主要成分是HCl。洁厕液与84消毒液混合后会发生氧化还原反应,生成有毒的氯气。写出该反应的离子方程式:______________________________。
(3)下列氧化还原反应中,与上述反应类型不同的是________。
A.Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O B.2FeCl3+Fe===3FeCl2
C.S+2H2SO4(浓)![]() 3SO2↑+2H2O D.KClO3+5KCl+3H2SO4===3K2SO4+3Cl2↑+3H2O
3SO2↑+2H2O D.KClO3+5KCl+3H2SO4===3K2SO4+3Cl2↑+3H2O
II.已知高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液可以发生氧化还原反应。请回答下列问题:
(1)该反应中的还原剂是________(填化学式)。
(2)写出该反应的离子方程式:____________________________________________。
(3)若生成1molCO2则转移电子_______mol
【答案】![]() NaCl ClO-+Cl-+2H+===Cl2↑+H2O A H2C2O4 2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 1mol
NaCl ClO-+Cl-+2H+===Cl2↑+H2O A H2C2O4 2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 1mol
【解析】
Ⅰ.次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;84消毒液的主要成分是NaCl和NaClO,有效成分是NaClO,长期露置于空气中,次氯酸钠与空气中二氧化碳反应生成碳酸钠、次氯酸和水,次氯酸遇光分解生成氧气和盐酸,盐酸与碳酸钠反应生成氯化钠、二氧化碳和水;洁厕灵的主要成分是盐酸,盐酸与NaClO发生归中反应,生成氯化钠、氯气和水;盐酸与NaClO发生归中反应,归中反应是同种元素既被氧化又被还原,同种元素变化后的化合价相等。II.高锰酸钾具有强氧化性,在硫酸酸化条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应中草酸是还原剂,高锰酸钾是氧化剂,反应中转移电子数目为10mol。
Ⅰ.(1)次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为:![]() ;84消毒液的主要成分是NaCl和NaClO,有效成分是NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO2
;84消毒液的主要成分是NaCl和NaClO,有效成分是NaClO,长期露置于空气中,发生反应:2NaClO+CO2+H2O=Na2CO3+2HClO,2HClO2![]() 2HCl+O2↑,Na2CO3+2HCl=
2HCl+O2↑,Na2CO3+2HCl=
2NaCl+CO2↑+H2O,故最终会变为NaCl溶液。(2)次氯酸钠有强氧化性,盐酸有强还原性,盐酸与NaClO反应生成氯化钠、氯气和水,反应的离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O;(3)盐酸与NaClO发生归中反应,归中反应是同种元素既被氧化又被还原,同种元素变化后的化合价相等,反应中硫元素既被氧化又被还原,反应后硫元素的化合价不相等,A错误;反应中铁元素既被氧化又被还原,反应后铁元素的化合价相等,B正确;反应中硫元素既被氧化又被还原,反应后硫元素的化合价相等,C正确;反应中氯元素既被氧化又被还原,反应后硫元素的化合价相等,D正确,故选A。II.(1)高锰酸钾具有强氧化性,在硫酸酸化条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应中草酸是还原剂,高锰酸钾是氧化剂;(2)在硫酸酸化条件下,高锰酸钾与H2C2O4反应生成硫酸钾、硫酸锰、CO2、水,反应中转移电子数目为10mol,反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;(3)由方程式可知,生成10mol CO2,反应中转移电子数目为10mol,则生成1mol CO2,反应中转移电子数目为1mol。

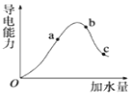
【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。