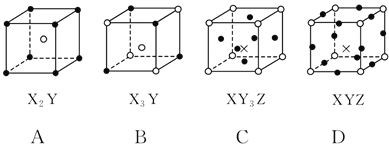
题目内容
【题目】工业废水、废渣不经处理,会对环境造成很大的危害。利用化学原理可以对工厂排放的废水、废渣等进行有效检测、处理及应用。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,Cr(Ⅲ)最终转化为CrOH(H2O)5SO4。
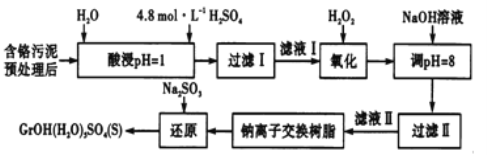
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒、量筒和胶头滴管外,还需_______,配制时所需浓H2SO4的体积为_______mL(小数点后保留一位数字)。
(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(5)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______。
(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为____________,阳极的电极反应式为____________。
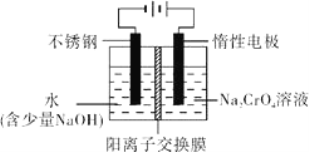
【答案】 250mL容量瓶 65.2 升高反应温度 加快搅拌速度 2Cr3++3H2O2+H2O=Cr2O72-+8H+ pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)的回收与再利用 Ca2+、Mg2+ 3Na2SO3+2Na2CrO4+15H2O=2CrOH(H2O)5SO4↓+Na2SO4+8NaOH 2H++2e-= H2↑(或4H2O+4e-= 2H2↑+4OH-) 4OH--4e-=2H2O+O2↑
【解析】分析:含铬污泥预处理后,用硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+,加入过氧化氢氧化铬离子为高价态,加入氢氧化钠溶液调节溶液PH=8使其他离子沉淀,过滤得到滤液用钠离子交换树脂交换镁离子和钙离子,得到溶液中通入Na2SO3还原得到Cr(OH)(H2O)5SO4,
(1)实验室用18.4mol·L-1的浓硫酸配制225mL4.8mol·L-1的H2SO4溶液,需要用250mL容量瓶配制,还用到胶头滴管;18.4mol/L×V=225mL×4.8mol/L,V=65.2mL;(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有高反应温度、增大固体颗粒的表面积等措施,(答出一点即可)。(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,反应的离子方程式为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)的回收与再利用 。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,钠离子交换树脂交换的离子是钙离子和镁离子。(5)Na2SO3具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为Na2SO4,Na2CrO4氧被还原为CrOH(H2O)5SO4,依据原子守恒分析书写配平3Na2SO3+2Na2CrO4+15H2O=2CrOH(H2O)5SO4↓+Na2SO4+8NaOH;(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为 2H++2e-= H2↑(或4H2O+4e-= 2H2↑+4OH-),阳极的电极反应式为 4OH--4e-=2H2O+O2↑。