题目内容
【题目】五种元素的原子电子层结构如下:
A.1s22s22p63s23p63d54s1;B.1s22s22p63s2;C.1s22s22p6;D.1s22s22p63s23p;E.[Ar]4s1。试回答:
(1)哪个式子是错误的________,它违背了________。
(2)哪个式子表示稀有气体原子________。
(3)A的元素符号是________,写出其价电子排布的轨道表示式________。
(4)B和E的金属性强弱关系为________(用元素符号表示),可以说明这一事实的依据是(写出2点)__________________________________。
【答案】 D 洪特规则 C Cr ![]() K>Mg K与冷水剧烈反应而Mg与沸水才反应,KOH(强碱)的碱性比Mg(OH)2(中强碱)强
K>Mg K与冷水剧烈反应而Mg与沸水才反应,KOH(强碱)的碱性比Mg(OH)2(中强碱)强
【解析】根据原子核外电子排布式可知,A是Cr、B是Mg、C是Ne、D 是Si、E是K;
(1) D错误,违背了洪特规则;正确答案:D;洪特规则。
(2) C为Ne原子的电子排布式;正确答案:C。
(3) A的核电荷数为24,表示Cr元素,其3d、4s为其价电子,所以其价电子排布的轨道表示式![]() ;正确答案:
;正确答案:![]() 。
。
(4) B是Mg、E是K,元素的金属性越强,其单质置换出氢气越容易、其最高价氧化物的水化物碱性越强,K元素的金属性比Mg元素强,K与冷水反应而Mg与热水反应,氢氧化钾属于强碱而氢氧化镁属于弱碱;正确答案:K>Mg; K与冷水剧烈反应而Mg与沸水才反应,KOH(强碱)的碱性比Mg(OH)2(中强碱)强。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】工业废水、废渣不经处理,会对环境造成很大的危害。利用化学原理可以对工厂排放的废水、废渣等进行有效检测、处理及应用。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,Cr(Ⅲ)最终转化为CrOH(H2O)5SO4。
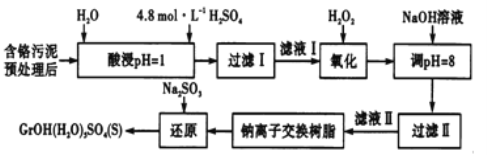
常温下,部分阳离子以氢氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒、量筒和胶头滴管外,还需_______,配制时所需浓H2SO4的体积为_______mL(小数点后保留一位数字)。
(2)酸浸时,为了提高浸取率,除了适当增大酸的浓度外,还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(5)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______。
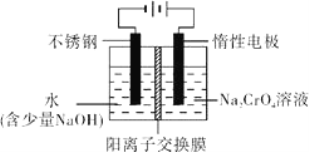
(6)工业上还可用电解法制备重铬酸钠,其装置示意图如图.阴极的电极反应式为____________,阳极的电极反应式为____________。
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
【答案】 ![]() +2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
+2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
【解析】试题分析:X、Y、Z、R、W、J是前五周期的元素,其中J为0族元素,所以X、Y、Z、R、W、J分别是N、O、F、S、Br、Xe;
解析:(1)R是S元素,原子的电子排布图为![]() 。
。
(2)化合物YZ2是OF2,F元素的化合价是-1,所以O元素的化合价为+2;O2-与Na+都有2个电子层,钠的质子数大于氧,所以半径大小为O2->Na+ 。
(3)同周期元素从左到右电负性增大,所以在N、O、F三种元素中,电负性由大到小的顺序是F>O>N;N原子2p能级半充满,能量低较稳定,第一电离能大于相邻的氧元素,N与O的第一电离能:N>O。
【题型】综合题
【结束】
22
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
