题目内容
14.下列说法不正确的是( )| A. | 1 mol氧的质量为32g | |
| B. | 标准状况下,0.5 mol NO和0.5 mol O2的混合气体体积约为22.4L | |
| C. | CO2的摩尔质量为44g/mol | |
| D. | 1L 2 mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
分析 A.氧没明确是分子还是原子;
B.标准状况下,1mol任何气体的体积约为22.4L;
C.摩尔质量的单位是g/mol,数值等于其式量;
D.氯离子浓度为氯化钡的2倍,根据n=cV计算氯离子物质的量,再根据N=nNA计算氯离子数目.
解答 解:A.没明确何种微粒,氧指分子还是原子,故A错误;
B.标准状况下,1mol任何气体的体积约为22.4L,任何气体既指一种气体或混合气体,0.5 mol NO和0.5 mol O2的混合气体为1mol,标准状况下体积约为22.4L,故B正确;
C.CO2的式量为44,摩尔质量为32g/mol,故C正确;
D.氯离子物质的量=1L×2mol/L×2=4mol,溶液中含Cl-的个数为4mol×6.02×1023mol-1=2.408×1024,故D正确;
故选A.
点评 本题考查物质的量有关计算,比较基础,难度不大,B选项为易错点,学生容易忽略共存问题,注意理解气体摩尔体积的使用条件与对象.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
4.在学习苯的化学反应时,我们得出的结论是苯易发生取代反应,难发生加成反应,下列物质中,苯基最容易发生取代反应的是( )
| A. | 苯 | B. | 甲苯 | C. | 苯甲醇 | D. | 苯酚 |
2.下列物质溶于水能电离出的Cl- 数目,一定与1mol BaCl2溶于水电离出的Cl- 数目相同的是( )
| A. | 2 molKClO3 | B. | 22.4LHCl气体 | C. | 2 molNaCl | D. | 1 mol AlCl3 |
19.(1)下列物质属于弱电解质的是④⑦(填序号,下同);属于非电解质的是②⑤;能导电的物质是①⑧⑩.
①氨水②蔗糖 ③烧碱 ④NH3•H2O ⑤CO2 ⑥氯气 ⑦CH3COOH ⑧铜 ⑨碳酸钙 ⑩石墨
(2)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO${\;}_{3}^{-}$+5SO${\;}_{3}^{2-}$+2H+═I2+5SO${\;}_{4}^{2-}$+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
①碘酸钾与亚硫酸钠的反应是氧化还原反应(填反应类型).
②该实验的两个目的分别是探究温度对反应速率的影响;探究Na2SO3的浓度对反应速率的影响.
③表中V2=40mL,V1=10mL.
④t1<t2<t3(填“<”、“>”或“=”).
①氨水②蔗糖 ③烧碱 ④NH3•H2O ⑤CO2 ⑥氯气 ⑦CH3COOH ⑧铜 ⑨碳酸钙 ⑩石墨
(2)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO${\;}_{3}^{-}$+5SO${\;}_{3}^{2-}$+2H+═I2+5SO${\;}_{4}^{2-}$+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol•L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3溶液的体积/mL | H2O的体 积/mL | 实验温 度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t 2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
②该实验的两个目的分别是探究温度对反应速率的影响;探究Na2SO3的浓度对反应速率的影响.
③表中V2=40mL,V1=10mL.
④t1<t2<t3(填“<”、“>”或“=”).
6.下列各组物质中,均为纯净物的一组是( )
| A. | 碘酒、硫酸 | B. | 臭氧、石油 | C. | 氢气、冰水混合物 | D. | NaOH、天然气 |
4.从海水中提取溴有如下反应5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O.与上述反应在氧化还原原理上最相似的是( )
| A. | 2H2S+SO2═3S↓+2H2O | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2NaBr+Cl2═2NaCl+Br2 | |
| D. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ |

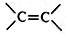 );下列试剂能与甲反应而褪色的是ac(填标号)
);下列试剂能与甲反应而褪色的是ac(填标号) +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$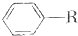 +HCl(-R为烃基)
+HCl(-R为烃基)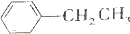 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$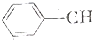 =CH2+H2
=CH2+H2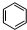 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$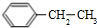 +HCl
+HCl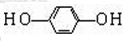 .
.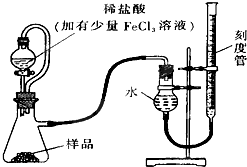 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量•
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量•