题目内容
11.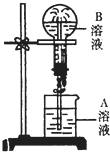 如图为喷泉实验装置图.
如图为喷泉实验装置图.(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质(如能用有关离子表示,请写出离子符号)的名称或离子符号.
| 实验编号 | A溶液颜色 | B溶液颜色 | A溶液中溶质 |
| ① | 无色 | 红色 | 酚酞 |
| ② | 黄色 | 红褐色浑浊 | Fe3+(FeCl3等) |
| ③ | 紫色 | 蓝色 | 石蕊 |
| ④ | 无色 | 乳白色浑浊 | Al3+或Mg2+(AlCl3、MgCl2等) |
 NH3•H2O
NH3•H2O NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
分析 氨水溶液呈碱性,滴加酚酞变红;可与Fe3+溶液反应生成红褐色沉淀,使紫色石蕊试液便蓝色,与氯化铝溶液反应乳白色氢氧化铝沉淀,以此解答该题.
解答 解:(1)①形成喷泉时B溶液变为红色,因氨水溶液呈碱性,则A中应滴加酚酞;
②A溶液黄色,且B溶液变成红褐色浑浊,说明生成氢氧化铁,A中含有Fe3+(FeCl3等);
③A溶液紫色,B溶液蓝色,因氨水使紫色石蕊试液便蓝色,则A为石蕊;
④A溶液无色,B为乳白色,可为氯化铝溶液与氨水的反应,生成氢氧化铝,
故答案为:①酚酞; ②Fe3+(FeCl3等); ③石蕊; ④Al3+或Mg2+(AlCl3、MgCl2等);
(2)氨水溶液呈碱性,滴加酚酞变红,发生NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-,实验②反应的离子方程式为Fe3++3 NH3•H2O=Fe ( OH )3↓+3 NH4+,
NH4++OH-,实验②反应的离子方程式为Fe3++3 NH3•H2O=Fe ( OH )3↓+3 NH4+,
故答案为:NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-,溶液呈碱性,遇酚酞显红色;Fe3++3 NH3•H2O=Fe ( OH )3↓+3 NH4+.
NH4++OH-,溶液呈碱性,遇酚酞显红色;Fe3++3 NH3•H2O=Fe ( OH )3↓+3 NH4+.
点评 本题综合考查氨气的性质,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及反应现象的判断,难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
1.A、B、C、D、E五种短周期元素的原子序数依次增大,A和D、C和E分别同主族,E的原子序数为C的两倍,B的最外层电子数为A的最外层电子数的4倍.下列叙述正确的是( )
| A. | A、B、C三种元素形成的化合物一定是非电解质 | |
| B. | A与C只能形成化学式为A2C的化合物 | |
| C. | 第三周期中,D的原子半径最大 | |
| D. | E的氧化物对应的水化物一定具有强氧化性 |
2.A、B是相对分子量不相等的两种有机物,无论A、B以何种比例混合,只要混合物的总质量不变,完全燃烧后生成CO2的质量也不变.符合这一条件的组合是( )
| A. | HCHO CH3COOH | B. | HCOOCH3 CH3COOH | ||
| C. | C2H4 C2H5OH | D. | CH3OH C10H8O2 |
19.常用一些图案标识危险化学品,化学物质与其图案标识不相符的是( )
| A. |  甲烷 | B. |  酒精 | C. |  浓盐酸 | D. |  烧碱 |
6.下列说法不正确的是( )
| A. | 油脂能发生皂化反应 | B. | 蛋白质水解的最终产物是氨基酸 | ||
| C. | 纤维素不能发生水解反应 | D. | 淀粉完全水解的产物是葡萄糖 |
16.下列气体中不能用碱石灰干燥的是( )
| A. | HCl | B. | CO2 | C. | NH3 | D. | SO2 |
3.元素性质呈现周期性变化的根本原因是( )
| A. | 元素的原子量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素化合价呈周期性变化 |
2.某同学在常温下设计以下实验流程探究Na2S2O3的化学性质:pH=8$\underset{\stackrel{①}{←}}{pH试纸}$Na2S2O3溶液$→_{同时加入氯化钡溶液}^{②加入足量氨水}$白色沉淀B
下列说法正确的是( )
下列说法正确的是( )
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=l0-8 mol.L-l | |
| B. | Na2S2O3溶液pH=8的原因用离子方程式表示为S2O32-+2H2O?Na2S2O3+2OH- | |
| C. | 生成的沉淀B可能是BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |