题目内容
1.A、B、C、D、E五种短周期元素的原子序数依次增大,A和D、C和E分别同主族,E的原子序数为C的两倍,B的最外层电子数为A的最外层电子数的4倍.下列叙述正确的是( )| A. | A、B、C三种元素形成的化合物一定是非电解质 | |
| B. | A与C只能形成化学式为A2C的化合物 | |
| C. | 第三周期中,D的原子半径最大 | |
| D. | E的氧化物对应的水化物一定具有强氧化性 |
分析 A、B、C、D、E五种短周期元素的原子序数依次增大,C和E同主族,E的原子序数为C的两倍,则C为O元素、E为S元素;
A和D同主族,B的最外层电子数为A的最外层电子数的4倍,则A、D处于IA族,B处于ⅣA族,而D的原子序数大于E,D只能处于第三周期、B处于第二周期,故B为C,D为Na,则A为H或Li,据此解答.
解答 解:A、B、C、D、E五种短周期元素的原子序数依次增大,C和E同主族,E的原子序数为C的两倍,则C为O元素、E为S元素;A和D同主族,B的最外层电子数为A的最外层电子数的4倍,则A、D处于IA族,B处于ⅣA族,而D的原子序数大于E,D只能处于第三周期、B处于第二周期,故B为C元素,D为Na元素,则A为H或Li元素,
A.A、B、C三种元素可以形成CH3COOH,属于电解质,故A错误;
B.A与C能形成化合物为H2O、H2O2,故B错误;
C.D为Na,处于IA族,同周期自左而右原子半径减小,故第三周期中Na的原子半径最大,故C正确;
D.E的氧化物对应的水化物有亚硫酸、硫酸,浓硫酸具有强氧化性,而亚硫酸、稀硫酸没有强氧化性,故D错误,
故选C.
点评 本题考查元素周期表、结构与位置关系,推断元素是解题的关键,注意对元素化合物知识的理解掌握.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
9.对下列装置作用的分析或解释正确的是( )
| A. | 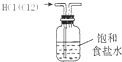 装置可除去HCl中的Cl2杂质 | |
| B. | 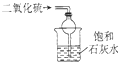 装置可吸收SO2,并防止倒吸 | |
| C. | 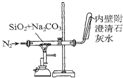 装置石灰水变浑浊即可证明非金属性:Si>C | |
| D. |  装置可制取并收集NO气体 |
16.下列关于常温下,pH=3的醋酸溶液(I)和 pH=11的氢氧化钠溶液(Ⅱ)的说法正确的是( )
| A. | I和Ⅱ的物质的量浓度均为0.001mol•L-1 | |
| B. | 将I稀释10倍,溶液中 c(CH3COOH)、c(OHˉ)均减小 | |
| C. | I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量 | |
| D. | I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH--) |
6.下列气态氢化物中最稳定的是( )
| A. | PH3 | B. | H2S | C. | HCl | D. | HBr |
13.下列说法正确的是( )
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 实验室制备硝基苯,将苯和浓硝酸混合后加热即可 | |
| C. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| D. | 1mol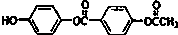 与足量的NaOH溶液加热充分反应,能消耗5molNaOH 与足量的NaOH溶液加热充分反应,能消耗5molNaOH |
11.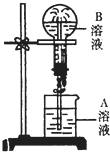 如图为喷泉实验装置图.
如图为喷泉实验装置图.
(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质(如能用有关离子表示,请写出离子符号)的名称或离子符号.
(2)分析实验①中B溶液变红色的原因(结合方程式说明)NH3+H2O NH3•H2O
NH3•H2O NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
 如图为喷泉实验装置图.
如图为喷泉实验装置图.(1)若大烧瓶内充入的为干燥NH3,要使喷泉形成表中的各种颜色,请写出A溶液里溶质(如能用有关离子表示,请写出离子符号)的名称或离子符号.
| 实验编号 | A溶液颜色 | B溶液颜色 | A溶液中溶质 |
| ① | 无色 | 红色 | 酚酞 |
| ② | 黄色 | 红褐色浑浊 | Fe3+(FeCl3等) |
| ③ | 紫色 | 蓝色 | 石蕊 |
| ④ | 无色 | 乳白色浑浊 | Al3+或Mg2+(AlCl3、MgCl2等) |
 NH3•H2O
NH3•H2O NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.  近年来太原市为建设“美丽太原”实施了一系列重要举措.
近年来太原市为建设“美丽太原”实施了一系列重要举措.

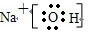 NH4Cl:
NH4Cl: CO2:
CO2: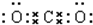 HClO:
HClO: NH3:
NH3: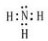 .
.
 .
. (写出结构简式).
(写出结构简式).