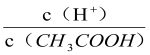题目内容
【题目】一定量的的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可向稀H2SO4中加入
A.CH3COONa固体 B.Na2SO4固体 C.少量NH4HSO4固体 D. NaOH固体
【答案】A
【解析】
试题分析:A.加CH3COONa(s),与硫酸反应生成醋酸,氢离子浓度减小,物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故A选;B.加Na2SO4固体,对反应无影响,反应速率不变,故B不选;C.加NH4HSO4固体,在溶液中电离出氢离子,同时铵根离子水解也生成氢离子,则生成氢气增多,故C不选;D.加NaOH固体,与硫酸反应,生成氢气减少,故D不选;故选A。

【题目】某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号 | 实验方案 | 实验现象 |
① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
② | 向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
(4)实验结论:____________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为_________、________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:_______、_____。
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与E形成的化合物的电子式是 ________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是______。
(4) F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________。