题目内容
【题目】X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
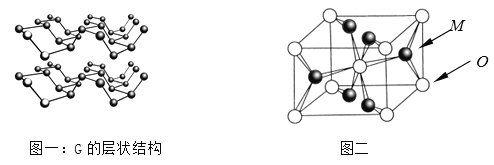
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
【答案】 ![]() CO2(或N2O) 直线形 中心原子(或离子)及配位原子半径的大小 氢键 A、D 2:1 几何因素 电荷因素
CO2(或N2O) 直线形 中心原子(或离子)及配位原子半径的大小 氢键 A、D 2:1 几何因素 电荷因素
【解析】X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子,说明X原子的同周期前一族元素的原子s轨道为全充满结构,则X为B,W为Al;Z元素基态原子的核外有3个未成对电子,说明p轨道上有3个电子,则Z为N元素,R为P元素,同时可知Y为C元素;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子,可推知M为Ti元素;
⑴N原子核外有5个电子,基态N原子价电子的电子排布图为![]() ;N3-的原子数为3,价电子总数为16, 则与N3-互为等电子体的分子可以是CO2(或N2O),等电子体结构相似,CO2是直线型,则N3-的空间构型是直线型;
;N3-的原子数为3,价电子总数为16, 则与N3-互为等电子体的分子可以是CO2(或N2O),等电子体结构相似,CO2是直线型,则N3-的空间构型是直线型;
⑵配合物中配位数的多少与中心原子(或离子)及配位原子半径的大小,B3+离子半径明显小于Al3+,则Al元素可形成[AlF6]3-、[AlCl4]-配离子,而B只能形成[BF4]-配离子;
⑶HCO3-之间以氢键作用形成长链,减小了HCO3-与水分子之间的作用,导致NaHCO3、KHCO3、NH4HCO3的溶解度明显小于对应的正盐Na2CO3、K2CO3及(NH4)2CO3的溶解度;
⑷A.则结构可知G中磷原子杂化方式为sp3杂化,故A正确;B.G中层与层之间的作用力是分子间作用力,故B错误;C.与石墨中碳原子为sp2杂化,每层原子均在同一平面内,但G中磷原子杂化方式为sp3杂化,每一层的各原子不可能在同一平面内,故c错误;D.G为原子晶体,而其它二种单质为分子晶体,则G的熔沸点最高,故D正确;答案为AD。
⑸观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6,而每个 氧原子周围最靠近的钛原子为3个,即氧化的配位数是3,则Ti、O配位数之比为6:3=2:1;晶胞的几何构型、微粒所带的电荷数及键性均是影响离子晶体结构类型的因素。

【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D