题目内容
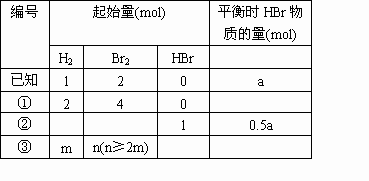
在一个固定容积的密闭容器中,保持一定温度进行以下反应H2(气)+Br2(气)![]() 2HBr(气).已知加入1mol H2和2mol Br2时,达到平衡后生成a mol HBr(见下表已知项).在相同条件下,且保持平衡时各组分百分含量不变,对下列编号①~③的状态填写空白;
2HBr(气).已知加入1mol H2和2mol Br2时,达到平衡后生成a mol HBr(见下表已知项).在相同条件下,且保持平衡时各组分百分含量不变,对下列编号①~③的状态填写空白;
答案:
解析:
解析:
|
分析: 对比状态①与已知量,可知状态①是已知量的 2倍.用“拆分法”把状态①看作两个已知状态达到平衡后予以压缩而得.
因为由 (Ⅰ)→(Ⅱ)过程的条件不变,所以(Ⅰ)与(Ⅱ)属同一平衡状态,各物质的百分含量不变,(Ⅱ)与(Ⅰ)具有相同的转化率;(Ⅱ)→(Ⅲ)的过程可看作增大压强,而该反应前后气体体积不变,所以平衡不发生移动,转化率不变,只是各物质的物质的量相应扩大为已知状态的2倍,故状态①平衡时HBr的物质的量为2a mol.可用“分割法’对比“已知状态”和“状态②”的平衡状态:
显然, (Ⅰ)、(Ⅱ)、(Ⅲ)均属同一平衡状态,平衡时(Ⅲ)的物质的量为已知状态各物质的物质的量的一半,故HBr平衡时的物质的量为0.5a mol,由“极限思维方法”分析可知,状态Ⅲ与1mol HBr+0.5mol Br2等效,故状态②起始量中H2的物质的量为零,Br2的物质的量为0.5mol.对于状态③可通过总结以上规律: a.起始状态中HBr的物质的量:n(HBr)=2[答:略. |

练习册系列答案
相关题目
在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)?xC(g);△H=?符合下图(a)所示的关系,由此推断关于图(b)的说法正确的是( )
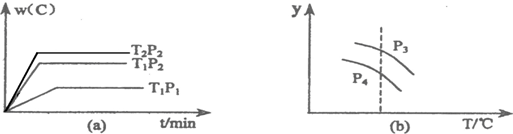

| A、P3>P4,y轴表示A的转化率 | B、P3<P4,y轴表示B的体积分数 | C、P3>P4,y轴表示混合气体的平均相对分子质量 | D、P3>P4,y轴表示混合气体的密度 |
在一个固定容积的密闭容器中,加入m mol A、n mol B,发生下列反应:mA(g)+nB(g)?pC(g),平衡时C的浓度是w mol/L,若容器体积和温度不变,起始时放入a mol A、b mol B、c mol C,若要平衡后C的浓度仍为w mol/L,则a、b、c应满足的关系是( )
| A、a:b:c=m:n:p | ||||||
B、a:b=m:n,
| ||||||
C、
| ||||||
D、a=
|
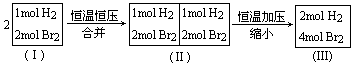
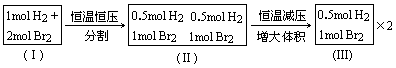
 2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下: 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中. 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.