题目内容
 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种.且均符合勒夏特列原理.请回答下列问题.(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)
3mol/L≤c(B)≤9mol/L
3mol/L≤c(B)≤9mol/L
;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是C
C
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.分析该溶液遇酚酞呈红色原因(用离子方程式表示)
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
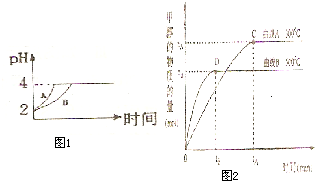
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2(选填“<”、“=”、“>”)(4)在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1mol?L-1的盐酸时,溶液中c(Ag+)
变小
变小
(选填“变大”、“变小”、“不变”)分析:(1)由正反应开始建立平衡,B的起始浓度最大,由逆反应开始建立平衡,B的起始浓度最小,据此计算;结合选项运用平衡移动原理分析解答;
(2)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,是因为碳酸钠水解呈碱性;
(3)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;pH值变化相同,醋酸参加反应的氢离子比盐酸多;
(4)根据沉淀溶解平衡的移动分析.
(2)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,是因为碳酸钠水解呈碱性;
(3)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;pH值变化相同,醋酸参加反应的氢离子比盐酸多;
(4)根据沉淀溶解平衡的移动分析.
解答:解:(1)由正反应开始建立平衡,B的起始浓度最大,B的浓度变化量为4mol/L×
=2mol/L,故B浓度最大值为7mol/L+2mol/L=9mol/L,
由逆反应开始建立平衡,B的起始浓度最小,B的浓度变化=2△c(A)=2mol/L×2=4mol/L,故B的浓度最小值为7mol/L-4mol/L=3mol/L,故B的起始浓度c(B)的取值范围是3 mol/L≤c(B)≤9 mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A.增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B.加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C.升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D.使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:3 mol/L≤c(B)≤9 mol/L;C;
(2)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,是因为碳酸钠水解呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-;故答案为:CO32-+H2O?HCO3-+OH-;
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2,
故答案为:B;<;
(4)AgCl饱和溶液中尚有AgCl固体存在,则溶液存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),当向溶液中加入0.1mol?L-1的盐酸时,平衡逆移,所以溶液中c(Ag+)变小,故答案为:变小.
| 1 |
| 2 |
由逆反应开始建立平衡,B的起始浓度最小,B的浓度变化=2△c(A)=2mol/L×2=4mol/L,故B的浓度最小值为7mol/L-4mol/L=3mol/L,故B的起始浓度c(B)的取值范围是3 mol/L≤c(B)≤9 mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A.增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B.加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C.升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D.使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:3 mol/L≤c(B)≤9 mol/L;C;
(2)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,是因为碳酸钠水解呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-;故答案为:CO32-+H2O?HCO3-+OH-;
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2,
故答案为:B;<;
(4)AgCl饱和溶液中尚有AgCl固体存在,则溶液存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),当向溶液中加入0.1mol?L-1的盐酸时,平衡逆移,所以溶液中c(Ag+)变小,故答案为:变小.
点评:本题考查较为综合,涉及弱电解质的电离、化学平衡、难溶电解质的溶解平衡、盐类水解等知识点,难度较大,弱电解质的电离平衡、化学平衡是高考的热点,应熟练掌握.

练习册系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: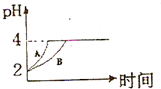 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是