题目内容
17.按要求填空(1)二氧化硫气体通入碘水,碘水褪色,该反应的化学方程式SO2+I2+2H2O=H2SO4+2HI
(2)实验室制备氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O
(3)制备漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(4)收集满一烧瓶纯的二氧化氮气体做喷泉实验,假设溶液不扩散,所得溶液的物质的量浓度$\frac{1}{22.4}$mol/L
(5)金属锌和硝酸物质的量之比为2:5恰好完全反应,该反应的化学方程式4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O.
分析 (1)二氧化硫具有还原性,能被卤素单质氧化,据此回答;
(2)实验室采用氯化铵和氢氧化钙加热的方法制取氨气;
(3)工业上是将氯气通入石灰乳中制备漂白粉;
(4)根据二氧化氮和水反应的方程式结合公式c=$\frac{n}{V}$计算溶液的物质的量浓度;
(5)物质的量之比为2:5的锌与稀硝酸恰好完全反应,金属锌全部生成硝酸锌,硝酸做氧化剂并显示酸性,根据产物和量的关系书写方程式即可.
解答 解:(1))二氧化硫具有还原性,能被卤素单质氧化,二者发生的反应为:SO2+I2+2H2O=H2SO4+2HI,故答案为:SO2+I2+2H2O=H2SO4+2HI;
(2)实验室采用氯化铵和氢氧化钙加热的方法制取氨气,二者发生的反应为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(3)工业上是将氯气通入石灰乳中制备漂白粉,二者发生的反应为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)根据反应方程式3NO2+H2O═2HNO3+NO可知,反应后生成气体为反应前气体的$\frac{1}{3}$,则最终水能充到烧瓶体积的$\frac{2}{3}$,设标况下气体体积为VL,则反应后气体体积为$\frac{1}{3}$VL,反应后溶液体积也是$\frac{1}{3}$VL,则反应后所得溶液浓度为:c=$\frac{\frac{V}{22.4}×\frac{2}{3}}{\frac{2V}{3}}$=$\frac{1}{22.4}$mol/L,故答案为:$\frac{1}{22.4}$mol/L;
(5)锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,物质的量之比为2:5的锌与稀硝酸恰好完全反应,金属锌全部生成硝酸锌,根据元素守恒和电子守恒,得到反应表达为:4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O,故答案为:4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O.
点评 本题考查学生物质的性质以及化学方程式的书写知识,注意知识的归纳和梳理是解体的关键,难度中等.

| A. | 3,3-二甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4-三甲基戊烷 | D. | 2,3,3-三甲基己烷 |
| A. | 10种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | 丙炔 | B. | 1-丁炔 | C. | 3-己炔 | D. | 2-庚炔 |
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
| A. | 水结成冰体积膨胀 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
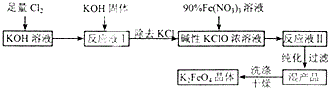 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下: