��Ŀ����
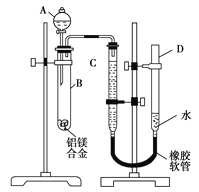
����Ŀ���̲���������KMnO4��Һ��H2C2O4�����ᣩ��Ӧ�о�Ӱ�췴Ӧ���ʵ����أ����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��һʵ��С����ͨ���ⶨ��λʱ��������CO2�����ʣ�̽��ij��Ӱ�컯ѧ��Ӧ���ʵ����أ����ʵ�鷽����ͼһ�ͱ��� 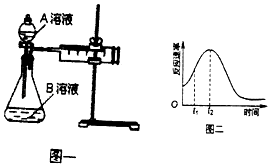
ʵ����� | A��Һ | B��Һ |
�� | 20 mL 0.1 molL��1H2C2O4��Һ | 30 mL 0.01 molL��1kMnO4��Һ |
�� | 20 mL 0.2 molL��1 | 30 mL 0.01 molL��1KMnO4��Һ |
��1���õ��뷽��ʽ��ʾ������Һ�����Ե�ԭ��
��2����ʵ��̽���������ضԻ�ѧ��Ӧ���ʵ�Ӱ�죮��ͬʱ������Ͳ������CO2�������С��ϵ�Ǣ��ڣ��������������=����
��3����ʵ�����2minĩ�ռ���896mL CO2����״���£�������MnO4����ʾ��ʱ���ڵĻ�ѧ��Ӧ����Ϊv ��MnO4����= ��
��4����ͨ���ⶨһ��ʱ����CO2��������ȽϷ�Ӧ���ʣ���ʵ�黹��ͨ���ⶨ���Ƚϻ�ѧ��Ӧ���ʣ�
��5����ʵ��С��ͬѧ���ַ�Ӧ������ͼ����ʾ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ��ٸ÷�Ӧ���ȡ��� ��
���𰸡�
��1��H2C2O4?H++HC2O4����HC2O4��?H++C2O42��
��2��Ũ�ȣ���
��3��0.08mol/��L?min��
��4��������ͬ���CO2����Ҫ��ʱ�䣨��KmnO4��Һ��ȫ��ɫ��ʱ�䣩
��5����Ӧ����
���������⣺��1�������Ƕ�Ԫ���ᣬ��ˮ��Һ�в�����ȫ���룬�ҷֲ������Ե�һ������Ϊ�������뷽��ʽΪ��H2C2O4H++HC2O4�� �� HC2O4��H++C2O42�� �� ���Դ��ǣ�H2C2O4H++HC2O4����HC2O4��H++C2O42������2���ԱȢ٢�ʵ���̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬����A��Һ��Ũ�ȱȢ��д�ѧ��Ӧ���ʴ�����CO2�������
���Դ��ǣ�Ũ�ȣ�������3��CO2�����ʵ����ǣ� ![]() =0.04mol����2minĩ��Ӧ���ĵ�n��MnO4����Ϊx��
=0.04mol����2minĩ��Ӧ���ĵ�n��MnO4����Ϊx��
2MnO4��+ | 5H2C2O4+6H+ | = | 2Mn2++ | 10CO2��+ | 8H2O |
2 | 10 | ||||
x | 0.04mol |
��ã�x=0.08mol��
v��MnO4����= ![]() =0.08mol/��Lmin����
=0.08mol/��Lmin����
���Դ��ǣ�0.0056����4��ͨ���ⶨKMnO4��Һ��ȫ��ɫ����ʱ��������ͬ������������ʱ�����Ƚϻ�ѧ��Ӧ���ʣ�
���Դ��ǣ�������ͬ���CO2����Ҫ��ʱ�䣨��KmnO4��Һ��ȫ��ɫ��ʱ�䣩����5�������ܼӿ컯ѧ��Ӧ�����ʣ�����Mn2+����MnSO4���Ƿ�Ӧ�Ĵ��������ⷴӦ�ͷ�������Ҳ����ʹ��ѧ��Ӧ���ʼӿ죬
���Դ��ǣ���Ӧ���ȣ�