题目内容
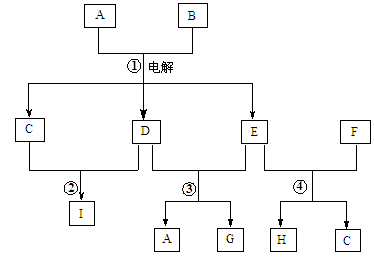
如图中,A、B、C、D、E是单质,F、G、H、I是B、C、D、E分别和A形成的化合物。已知:①G、H的化学式为“X2Y3”形式,F的化学式为“XY”形式;②I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨, E可以在I中燃烧,发生置换反应;③F中的A元素的质量分数为40%。回答问题:

(1)I和E反应的化学方程式为: 。(2分)
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应。C和A形成的化合物H与氢氧化钠溶液反应的离子方程式为: 。(2分)电解H可以制取C, 反应的化学方程式为: 。(2分)
(3)G是一种红棕色粉末,向一定量的G中加入足量硫酸,反应的化学方程式为: 。(2分)向反应后的溶液中加入足量铁粉,反应的离子方程式为: 。(2分)
(4)G与盐酸反应的离子方程式为: 。(2分)得到的溶液中加入铜粉,反应的离子方程式为: 。(2分)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需铜粉 g(3分)。
(1)2Mg+CO2 2MgO+C(2分)(2)Al2O3+2OH-=2AlO2-+H2O(2分)
2MgO+C(2分)(2)Al2O3+2OH-=2AlO2-+H2O(2分)
2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O(2分)2Fe3++Fe=3Fe2+(2分)
(4)Fe2O3+6H+=2Fe3++3H2O(2分) Cu+2Fe3+=Cu2++2Fe2+(2分) 0.64g(1分)
解析试题分析:I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨,这说明I是二氧化碳。E可以在I中燃烧,发生置换反应2E+I=2F+D,推断E为金属单质Mg,发生的反应为,2Mg+CO2 2MgO+C,F为MgO,D为单质C;MgO中的氧元素的质量分数为40%,证明推断正确.因此E是镁,则A是氧气,D是碳,F是氧化镁。
2MgO+C,F为MgO,D为单质C;MgO中的氧元素的质量分数为40%,证明推断正确.因此E是镁,则A是氧气,D是碳,F是氧化镁。
(1)I和E反应的化学方程式为2Mg+CO2 2MgO+C。
2MgO+C。
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应,说明C是金属铝。C和A形成的化合物H是氧化铝,属于两性氧化物与氢氧化钠溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;电解氧化铝可以制取铝, 反应的化学方程式为2Al2O3 4Al+3O2↑。
4Al+3O2↑。
(3)G是一种红棕色粉末,则G是氧化铁。向一定量的G中加入足量硫酸,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;铁离子能氧化单质铁,因此向反应后的溶液中加入足量铁粉,反应的离子方程式为2Fe3++Fe=3Fe2+。
(4)氧化铁与盐酸反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O;铁离子能氧化单质铜,因此得到的溶液中加入铜粉,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;1.6g 氧化铁的物质的量是1.6g÷160g/mol=0.01mol,根据方程式Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+可知 Fe2O3~Cu,则需要铜的物质的量是0.01mol,铜粉的质量是0.64g。
考点:考查无机物推断

A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其它七种元素
| 图1 | |||
| A | B | C | |
| D | | E | F |
| 图2 | |||
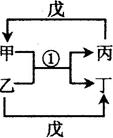 | |||
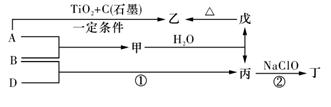
不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。请回答下列问题:
(1)已知图2中反应①是复分解反应,生成物中水已略去。
a.若戊是含有18电子的双原子分子,则甲的电子式为:_________。实验室制取气体丙的化学方程式为:___________________________。
b.若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用做干燥剂,写出甲的一种用途 。
c.若将a和b中甲的饱和溶液混合,会出现白色胶状沉淀,同时伴有刺激性气味的气体产生,则该反应的离子方程式: 。
(2)已知图2中反应①是置换反应,戊是单质,则戊可能是 或 ,分别写出一个对应的反应①的化学方程式 、 。

 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑