题目内容
(15分)氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇,在工业上用作酸性清洗剂、阻燃剂、磺化剂等。市售商品为白色粉末,在常温下,只要保持干燥不与水接触,固体的氨基磺酸不吸湿,比较稳定。它具有不挥发、无臭味和对人体毒性极小的特点。某实验组用尿素和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下 “磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
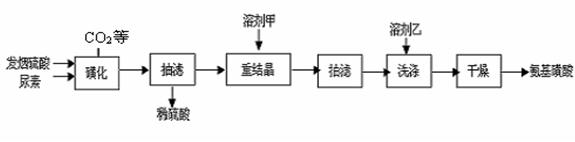
(1)下图是“磺化”过程的实验装置,恒压滴液漏斗的作用是 ____________

(2)抽滤时,所得晶体要用溶剂乙醇洗涤,则洗涤的具体操作是
(3)实验过程的讨论分析:
①重结晶时用溶剂甲(10%~12%的硫酸)作重结晶的溶剂用而不用水作溶剂的原因是
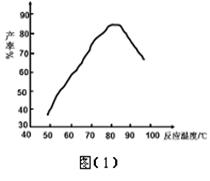
② “磺化”过程温度与产率的关系如图(1),控制反应温度为75~80℃为宜,若温度高于80℃,氨基磺酸的产率会降低,原因是 。
(4)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2000mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。
①以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有 _____ 杂质。
②写出NaNO2滴定法中的化学方程式为: 。
③试求产品中氨基磺酸的质量分数__________________________。
①CO(NH2)2(s) + SO3(g)
 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0②H2NCONHSO3H + H2SO4
 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
(1)下图是“磺化”过程的实验装置,恒压滴液漏斗的作用是 ____________

(2)抽滤时,所得晶体要用溶剂乙醇洗涤,则洗涤的具体操作是
(3)实验过程的讨论分析:
①重结晶时用溶剂甲(10%~12%的硫酸)作重结晶的溶剂用而不用水作溶剂的原因是
② “磺化”过程温度与产率的关系如图(1),控制反应温度为75~80℃为宜,若温度高于80℃,氨基磺酸的产率会降低,原因是 。

(4)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2000mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。
①以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有 _____ 杂质。
②写出NaNO2滴定法中的化学方程式为: 。
③试求产品中氨基磺酸的质量分数__________________________。
(1)、平衡压强,使发烟硫酸能顺利的滴下。(2分)
(2)、先关小水龙头,然后在布氏漏斗中加入乙醇洗涤剂没过沉淀,使洗涤剂缓慢通过晶体,洗涤2-3次(2分)
(3)、①、抑制氨基磺酸的电离(或有利于氨基磺酸析出或氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小。(2分)
②、温度高,SO3气体逸出加快,使反应①转化率降低;同时温度高,反应①平衡向逆反应方向移动(2分)
(4) 、①硫酸(或H2SO4)(2分㈡H2NSO3H + NaNO2=NaHSO4+ N2 ↑+H2O(2分)
③ 98.0% (3分)
(2)、先关小水龙头,然后在布氏漏斗中加入乙醇洗涤剂没过沉淀,使洗涤剂缓慢通过晶体,洗涤2-3次(2分)
(3)、①、抑制氨基磺酸的电离(或有利于氨基磺酸析出或氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小。(2分)
②、温度高,SO3气体逸出加快,使反应①转化率降低;同时温度高,反应①平衡向逆反应方向移动(2分)
(4) 、①硫酸(或H2SO4)(2分㈡H2NSO3H + NaNO2=NaHSO4+ N2 ↑+H2O(2分)
③ 98.0% (3分)
(1)恒压的作用是平衡压强,使发烟硫酸能顺利的滴下。
(2)洗涤时要在过滤器中洗涤,所以应该是先关小水龙头,然后在布氏漏斗中加入乙醇洗涤剂没过沉淀,使洗涤剂缓慢通过晶体,洗涤2-3次。
(3)①利用硫酸作溶剂抑制氨基磺酸的电离。
②温度过高,SO3气体逸出加快,使反应①转化率降低;同时温度高,反应①平衡向逆反应方向移动,所以氨基磺酸的产率会降低。
(4)①测定结果偏高。说明含有能与氢氧化钠反应的杂质,所以含有的杂质应该是硫酸。
②亚硝酸钠具有强氧化性,能把氨基磺酸氧化生成氮气,所以方程式为H2NSO3H + NaNO2=NaHSO4+ N2 ↑+H2O。
③消耗亚硝酸钠是0.08000mol·L-1×0.025L=0.002mol,所以根据方程式可知,氨基磺酸的物质的量是0.002mol,则质量分数为ω(H2NSO3H)=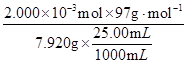 ×100% = 98.0% 。
×100% = 98.0% 。
(2)洗涤时要在过滤器中洗涤,所以应该是先关小水龙头,然后在布氏漏斗中加入乙醇洗涤剂没过沉淀,使洗涤剂缓慢通过晶体,洗涤2-3次。
(3)①利用硫酸作溶剂抑制氨基磺酸的电离。
②温度过高,SO3气体逸出加快,使反应①转化率降低;同时温度高,反应①平衡向逆反应方向移动,所以氨基磺酸的产率会降低。
(4)①测定结果偏高。说明含有能与氢氧化钠反应的杂质,所以含有的杂质应该是硫酸。
②亚硝酸钠具有强氧化性,能把氨基磺酸氧化生成氮气,所以方程式为H2NSO3H + NaNO2=NaHSO4+ N2 ↑+H2O。
③消耗亚硝酸钠是0.08000mol·L-1×0.025L=0.002mol,所以根据方程式可知,氨基磺酸的物质的量是0.002mol,则质量分数为ω(H2NSO3H)=
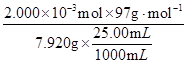 ×100% = 98.0% 。
×100% = 98.0% 。
练习册系列答案
相关题目
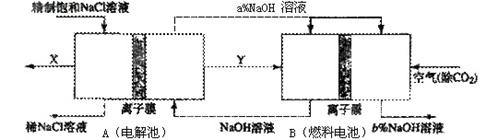 ①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
 。 400℃、30MPa下n(NH3)和n(H2)
。 400℃、30MPa下n(NH3)和n(H2)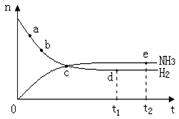
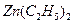 .
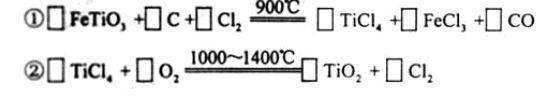
.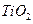 ) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分
) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分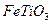 ),为原料按下过程进行的,请
),为原料按下过程进行的,请 完成下列化学方程式
完成下列化学方程式