题目内容
(15分)【化学---化学与技术】
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
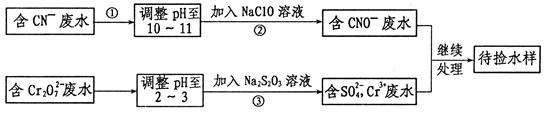
回答下列问题:
(1)上述处理废水流程中主要采用的方法是 。
(2)流程②中,反应后无气体放出,该反应的离子方程式为 。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为: 。
(5)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因: 。
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
(1)上述处理废水流程中主要采用的方法是 。
(2)流程②中,反应后无气体放出,该反应的离子方程式为 。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为: 。
(5)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因: 。
(1)氧化—还原法(2分) (2)CN-+ClO- CNO-+Cl-(3分)
(3)调节废水pH,使其转化成Cr(OH)3沉淀除去(4分,其他合理答案也给分)
(4)3S2O32-+4Cr2O72-+26H+ 6SO42-+8Cr3++13H2O(3分)
(5)Cu2++2OH- Cu(OH)2↓ 、 Cu(OH)2(s)+S2-(aq) CuS(s)+2OH-(aq)
或Ksp(CuS)<Ksp[Cu(OH)2],使沉淀向更难溶方向转化。(3分)
(3)调节废水pH,使其转化成Cr(OH)3沉淀除去(4分,其他合理答案也给分)
(4)3S2O32-+4Cr2O72-+26H+ 6SO42-+8Cr3++13H2O(3分)
(5)Cu2++2OH- Cu(OH)2↓ 、 Cu(OH)2(s)+S2-(aq) CuS(s)+2OH-(aq)
或Ksp(CuS)<Ksp[Cu(OH)2],使沉淀向更难溶方向转化。(3分)
(1)次氯酸或Cr2O72-都具有氧化性,所以处理废水都方法都是氧化—还原法。
(2)反应后无气体放出,说明次氯酸钠都还原产物是氯化钠,而不是氯气,所以该反应的离子方程式为CN-+ClO- CNO-+Cl-。
(3)处理废水中的Cr3+,可以通过沉淀法,即调节废水pH,使其转化成Cr(OH)3沉淀除去。
(4)每消耗0.4 mol Cr2O72-转移2.4 mol e-,说明反应中转移6个电子,因此其还原产物是Cr3+。由于氧化产物是SO42-,所以方程式为3S2O32-+4Cr2O72-+26H+ 6SO42-+8Cr3++13H2O。
(5)蓝色沉淀是氢氧化铜,由于硫化铜的溶解度小于氢氧化铜的,所以根据沉淀转化的实质向更难溶方向转化,所以反应中生成硫化铜黑色沉淀。有关方程式为Cu2++2OH- Cu(OH)2↓ 、 Cu(OH)2(s)+S2-(aq) CuS(s)+2OH-(aq)。
(2)反应后无气体放出,说明次氯酸钠都还原产物是氯化钠,而不是氯气,所以该反应的离子方程式为CN-+ClO- CNO-+Cl-。
(3)处理废水中的Cr3+,可以通过沉淀法,即调节废水pH,使其转化成Cr(OH)3沉淀除去。
(4)每消耗0.4 mol Cr2O72-转移2.4 mol e-,说明反应中转移6个电子,因此其还原产物是Cr3+。由于氧化产物是SO42-,所以方程式为3S2O32-+4Cr2O72-+26H+ 6SO42-+8Cr3++13H2O。
(5)蓝色沉淀是氢氧化铜,由于硫化铜的溶解度小于氢氧化铜的,所以根据沉淀转化的实质向更难溶方向转化,所以反应中生成硫化铜黑色沉淀。有关方程式为Cu2++2OH- Cu(OH)2↓ 、 Cu(OH)2(s)+S2-(aq) CuS(s)+2OH-(aq)。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
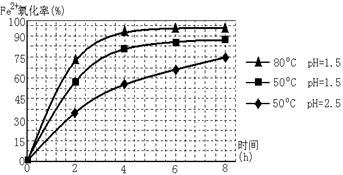
 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题: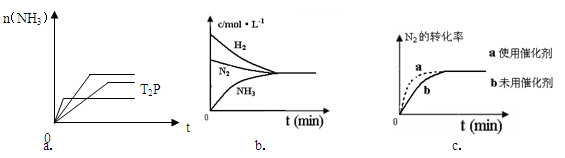
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。 。
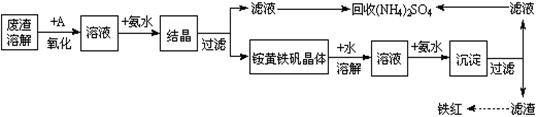
。 溶液,稍加热。
溶液,稍加热。 粉末至
粉末至 为
为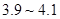 。
。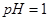 。
。
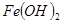
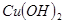
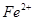 氧化为
氧化为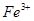 的目的是 。
的目的是 。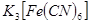 (铁氰化钾)验证II中
(铁氰化钾)验证II中 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑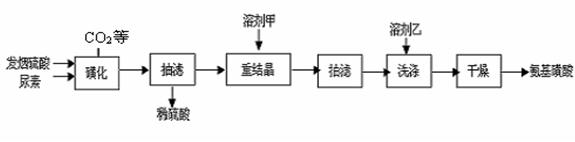

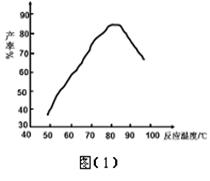

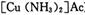 )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为: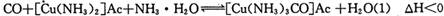
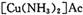 氧化为
氧化为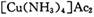 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;