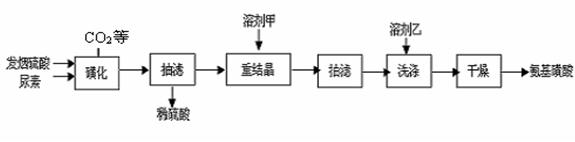
题目内容
关于工业制硫酸的说法不正确的是( )
| A.燃烧硫生成SO3 | B.SO3与水反应生成H2SO4 |
| C.SO2氧化成SO3需要使用催化剂 | D.主要设备是沸腾炉、接触室、吸收塔 |
A
试题分析:S燃烧生成的是SO2,得不到三氧化硫,选项A不正确,其余选项都是正确的,答案选A。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查,难度不大。主要是有利于巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目
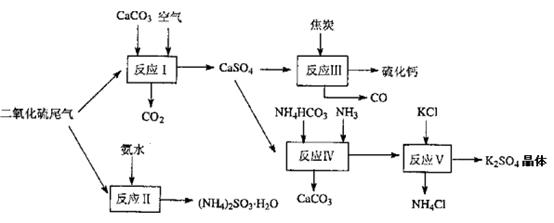
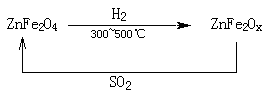
 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
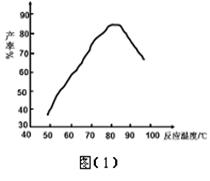
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑