题目内容
【化学一选修2化学与技术】(15分)
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下:
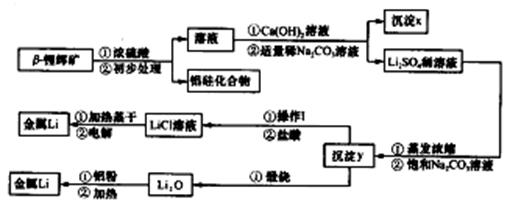
请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下:

请回答:(1)沉淀y的主要成分的化学式是 。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是 。
(3)操作I涉及的实验方法是 。
(4)写出用铝粉还原法制取金属锂的化学方程式 。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是 。
(6)目前电池通常使用金属锂的优点是 。
(1)Li2CO3(2分)
(2)加稀Na2CO3溶液既能除去溶液中的Ca2+,又不生成Li2CO3沉淀;(2分)
加饱和Na2CO3溶液的目的是使Li +转化生成Li2CO3沉淀。(1分)(其他合理答案参照给分)
(3)过滤、洗涤(各1分)
(4)3 Li2O +4Al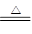 2 Al2O3+3Li (3分)
2 Al2O3+3Li (3分)
(5)LiCl溶液在加热蒸干过程中有部分LiOH生成,LiOH受热分解为Li2O,熔融的Li2O电解生成氧气。(3分)
(6)锂的密度小,质能比高;锂电池为可充电绿色环保电池。(2分,其它合理答案也给分)
(2)加稀Na2CO3溶液既能除去溶液中的Ca2+,又不生成Li2CO3沉淀;(2分)
加饱和Na2CO3溶液的目的是使Li +转化生成Li2CO3沉淀。(1分)(其他合理答案参照给分)
(3)过滤、洗涤(各1分)
(4)3 Li2O +4Al
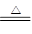 2 Al2O3+3Li (3分)
2 Al2O3+3Li (3分)(5)LiCl溶液在加热蒸干过程中有部分LiOH生成,LiOH受热分解为Li2O,熔融的Li2O电解生成氧气。(3分)
(6)锂的密度小,质能比高;锂电池为可充电绿色环保电池。(2分,其它合理答案也给分)
(1)硫酸锂和碳酸钠反应的生成物是硫酸钠和碳酸锂,根据Y灼烧的产物是氧化锂可知,Y是碳酸锂。
(2)第一次用稀碳酸钠溶液,是为了防止生成碳酸锂,同时又可以除去钙离子。而第二次是为了生成碳酸锂,所以浓度要大。
(3)从溶液中分离出固体的方法应是过滤,过滤后晶体必须洗涤。
(4)在加热的条件下,铝可以发生铝热反应,方程式为3 Li2O +4Al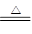 2 Al2O3+3Li。
2 Al2O3+3Li。
(5)电解池中氯离子在阳极放电,有氧气生成,说明氧离子在阳极也放电,这是由于LiCl溶液在加热蒸干过程中有部分LiOH生成,LiOH受热分解为Li2O,熔融的Li2O电解生成氧气。
6)锂的密度小,质能比高;锂电池为可充电绿色环保电池。
(2)第一次用稀碳酸钠溶液,是为了防止生成碳酸锂,同时又可以除去钙离子。而第二次是为了生成碳酸锂,所以浓度要大。
(3)从溶液中分离出固体的方法应是过滤,过滤后晶体必须洗涤。
(4)在加热的条件下,铝可以发生铝热反应,方程式为3 Li2O +4Al
 2 Al2O3+3Li。
2 Al2O3+3Li。(5)电解池中氯离子在阳极放电,有氧气生成,说明氧离子在阳极也放电,这是由于LiCl溶液在加热蒸干过程中有部分LiOH生成,LiOH受热分解为Li2O,熔融的Li2O电解生成氧气。
6)锂的密度小,质能比高;锂电池为可充电绿色环保电池。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题: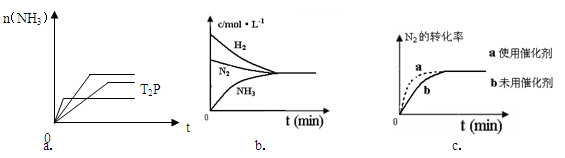
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑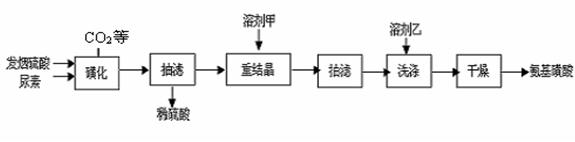

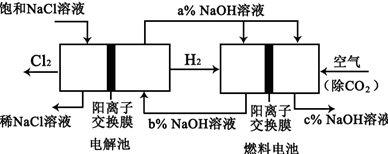

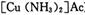 )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为: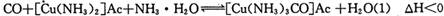
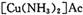 氧化为
氧化为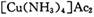 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;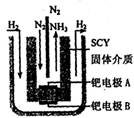
 量制备H2
量制备H2
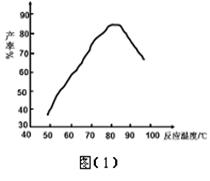
 的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为 kg。
质量为 kg。