题目内容
【题目】丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g)=6CO(g)+8H2O(1) △H1 =-2741.8 kJmol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJmol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) △H=____________;
(2)现有1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=+41.2kJmol-1
①下列事实能说明该反应达到平衡的是_____________;
a.体系中的压强不再变化 b.v正( H2) = v逆( CO ) c.混合气体的平均相对分子质量不再变化 d.CO2 的浓度不再发生变化
②5min 后体系达到平衡,经测定,容器中含 0.8 mol H2,则平衡常数K =______;
③其他条件不变,向平衡体系中充入少量CO,则平衡常数K______(填“增大”、“减小”或“不变”)
(3)根据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体 ;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向______极移动(填“正”或“负”);电池的负极电极反应为________。
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为___________。
【答案】-2219.9kJ/mol bd 3.5 不变 负 C3H8+10O2--20e-=3CO2↑+4H2O 生成无色气体和白色沉淀
【解析】
利用盖斯定律进行计算;根据平衡状态的判断依据进行判断;根据“三段式”列出平衡常数表达式进行计算,化学平衡常数只受温度的影响;根据燃料电池的原理写出电极反应和离子移动的方向;根据离子的放电顺序写出电极反应,根据电极反应描述实验现象。
(1)将题给两个热化学方程式依次编号为①、②,利用盖斯定律,根据所求的热化学方程式![]() ,即得C3H8(g)+5O2(g)=3CO2(g) +4H2O(1)△H=
,即得C3H8(g)+5O2(g)=3CO2(g) +4H2O(1)△H=![]() = -2219.9kJ/mol;
= -2219.9kJ/mol;
(2)①a.反应CO(g)+H2O(g)CO2(g)+H2(g)是一个反应前后气体体积不变的吸热反应,反应过程中压强始终不变,压强不变不能作为判断平衡的标志,故a不选;
b.当正逆反应速率相等时,反应已达平衡,故b选;
c.混合气体的平均相对分子质量由M=![]() 可得,m和n始终不变,故M始终不变,平均相对分子质量不变不能作为判断平衡的标志,故c不选;
可得,m和n始终不变,故M始终不变,平均相对分子质量不变不能作为判断平衡的标志,故c不选;
d.二氧化碳的浓度不再变化,说明反应已达平衡,故d选;
答案为bd;
②1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,根据元素守恒可知,则生成水为4mol,5min 后体系达到平衡,经测定,H2为0.8mol,容器的体积为1L,则列出“三段式”
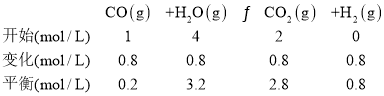
因此K=![]() ;
;
③由于平衡常数只与温度有关,所以在温度不变时再充入少量CO,平衡常数是不变的;
(3) 根据原电池的工作原理,电池内部电解质中的阴离子由正极向负极移动,其中通空气的一极为正极,通丙烷的一极为负极,则正极反应式为O2+4e-=2O2-,而负极反应式为C3H8+10O2--20e-=3CO2+4H2O;
(4) 用惰性电极电解足量Mg(NO3)2和NaCl 的混合溶液,阴极附近溶液中优先放电的阳离子是H+,电极反应式为2H2O2e=H2↑+2OH,同时在阴极附近的溶液中生成的OH-与Mg2+结合生成Mg(OH)2沉淀:Mg2++2OH=Mg(OH)2↓,所以电解开始后,阴极附近的现象是生成无色气体和白色沉淀。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键