题目内容
【题目】下列判断正确的是 ( )
A.在稀氨水中加水稀释,![]() 会增大
会增大
B.若酸性HA>HB,则等物质的量浓度等体积的NaA和NaB溶液混合有关系: c(OH-)>c(A-)>c(B-)>c(H+)
C.0.1 mol·L-1的一组溶液pH由大到小排列为: NaOH>Na2CO3>NaHSO4>(NH4)2SO4
D.分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸
【答案】A
【解析】
A.溶液越稀越电离,弱电解质的电离程度增大;
B.弱离子水解时,生成的弱酸酸性越弱,则水解程度越大;
C.硫酸氢钠在水溶液中完全电离出三种离子:钠离子,氢离子和硫酸根离子;
D.弱酸稀释中会促进弱酸的电离。
A.溶液越稀越电离,加水稀释氨水,会使电离平衡右移, ![]() 会增大,故正确;
会增大,故正确;
B.弱离子水解时,生成的弱酸酸性越弱,则水解程度越大,酸性HA>HB,说明NaB溶液中阴离子的水解程度大于NaA中阴离子的水解程度,所以c(A-)>c(B-),氢氧根是弱离子水解生成的,其浓度比弱的阴离子的小,所以离子浓度关系: c(A-)>c(B-)>c(OH-)>c(H+),故错误;
C. 氢氧化钠完全电离,溶液显强碱性,碳酸钠水解显碱性,硫酸氢钠在水溶液中完全电离出三种离子:钠离子,氢离子和硫酸根离子,溶液显强酸性,硫酸铵水解显酸性,所以pH由大到小排列为:NaOH> Na2CO3>(NH4)2SO4>NaHSO4,故错误;
D. 盐酸是强酸,醋酸是弱酸,弱酸稀释中会促进弱酸的电离, 稀释10mLpH=1的盐酸至100mL,pH=2;稀释10mLpH=1的醋酸至100mL,pH小于2;错误;
综上所述,本题正确选项A。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
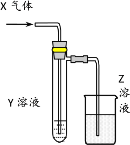
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D