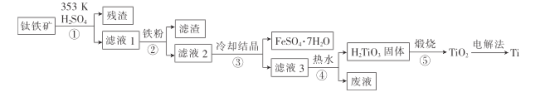
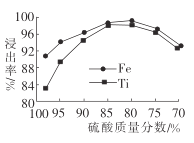
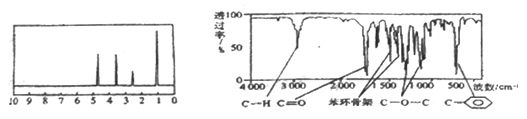
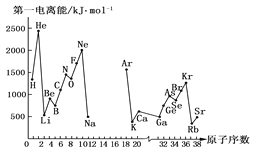
题目内容
【题目】现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
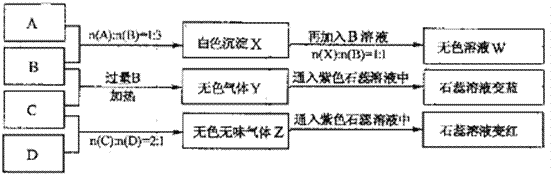
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为_______、_______。
(2)D溶液pH__(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)__________。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是________________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是______________________________________________________________
【答案】Al2O3 NaAlO2 大于 CO32-+H2O![]() HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-)
HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-)
【解析】
由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体,Z为CO2,
(1)加热促进盐类的水解,根据盐类水解原理分析;
(2) 强碱弱酸盐,水解显碱性;
(3)根据酸、碱的电离以及盐类的水解的角度比较溶液pH的大小;
(4)从盐类水解的影响因素以及平衡移动的角度分析;
(5)从溶液电荷守恒的角度分析。
由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体Z为CO2;
(1)A是AlCl3,AlCl3水解:Al3++3H2OAl(OH)3+3H+,升高温度,氯化氢挥发,平衡右移,灼烧氢氧化铝,分解为氧化铝;W是NaAlO2,水解:AlO2-+2H2O Al(OH)3+OH-,升温后,平衡左移,因为氢氧根离子的存在,不存在Al(OH)3,溶液蒸干后得到NaAlO2固体;
故答案为Al2O3、NaAlO2;
(2)碳酸钠属于强碱弱酸盐,水解显碱性,离子方程式为:CO32-+H2O![]() HCO3-+OH-,溶液pH大于7;
HCO3-+OH-,溶液pH大于7;
故答案为大于;CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)其中NaOH和Na2CO3呈碱性的pH大于7,而且NaOH碱性> Na2CO3, AlCl3和NH4HSO4呈酸性, pH小于7,NH4HSO4酸性> AlCl3,所以等物质的量浓度A、B、C、D的pH由大到小的顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;
答案是: NaOH>Na2CO3>AlCl3>NH4HSO4;
(4)等物质的量浓度的NH4HSO4与NH4Cl溶液, NH4HSO4电离出的H+对NH4+的水解起到抑制作用,所以c(NH4+)前者>后者;
答案是: >;
(5)B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中存在硫酸钠、硫酸铵以及氨水等溶质,混合溶液呈中性,则c(H+)=c(OH-),由电荷守恒有c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-);
答案是: c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-).

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲