题目内容
【题目】制烧碱所用盐水需两次精制。
第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(1)过程Ⅰ除去的离子是_______________。
(2)检测Fe3+是否除尽的方法是____________________。
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因______________。
(4)除去Mg2+的离子方程式是________________。
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____________。
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
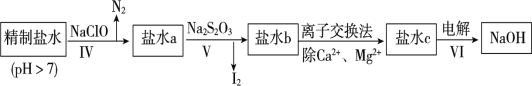
(6)过程Ⅳ除去的离子是__________________。
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释___________。
【答案】SO42- 取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe 3+已除尽;反之没除尽 BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全 2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑ 在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全 NH4+、I- H+在阴极上得电子变成H2逸出,使H2O![]() H++OH-的电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成
H++OH-的电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成
【解析】
(1)根据钡离子能够与硫酸根离子反应生成硫酸钡沉淀进行解答;
(2)根据Fe3+遇SCN-溶液会变为血红色检验铁离子是否除尽;
(3)根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
(4)Mg2+能够与CO32-反应生成Mg2(OH)2CO3沉淀,从而除去Mg2+杂质,据此写出反应的离子方程式;
(5)根据BaCO3、CaCO3、Mg2(OH)2CO3的溶解度进行分析;
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,精制盐水先加次氯酸钠,将NH4+氧化成氮气,同时将I-氧化成I2,在盐水a中再加入硫代硫酸钠,将IO3-还原成I2,同时被氧化成硫酸根离子,除去溶液中的I2,得盐水b,通过离子交换法除去Ca2+、Mg2+,得盐水c再电解得氢氧化钠溶液,
(6)次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
(7)根据电解原理及水的电离平衡H2O![]() H++OH-进行分析在电解槽的阴极区生成NaOH原理。
H++OH-进行分析在电解槽的阴极区生成NaOH原理。
(1)向粗盐水中加入过量BaCl2溶液,BaCl2电离产生Ba2+与溶液中的SO42-反应生成BaSO4沉淀,通过过滤除去BaSO4,从而除去杂质SO42-;
(2)检测Fe3+是否除尽的方法为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之Fe3+未除尽;
(3)BaSO4的溶度积为2.4×10-4,CaSO4的溶度积为2.6×10-2,显然CaSO4的溶度积大于BaSO4,即BaSO4的溶解度比CaSO4的小,所以加入BaCl2可将SO42-沉淀更完全;
(4)Mg2+能够与CO32-反应生成难溶物Mg2(OH)2CO3,反应的离子方程式为:2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑;
(5)根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全;
(6)根据上述分析可知,过程Ⅳ加入NaClO,ClO-能够氧化NH4+、I-,从而除去杂质NH4+、I-;
(7)电解过程中,H+在阴极上得电子变成H2逸出,溶液中c(H+)降低,使H2O![]() H++OH-的电离平衡正向移动,导致OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成。
H++OH-的电离平衡正向移动,导致OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成。

 名校课堂系列答案
名校课堂系列答案【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+-Mn2++CO2↑+H2O(未配平)
Ⅰ.甲同学研究外界因素对反应速率影响,设计如下实验方案:
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
A | 2mL | 20 | |
B | 2mL | 20 | 10滴饱和MnSO4溶液 |
C | 2mL | 30 | |
D | 1mL | 20 | V1mL蒸馏水 |
E | 0.5mL | 20 | V2mL蒸馏水 |
(1)完成上述实验方案设计,其中:V1= ______ ,V2= ______ ;
(2)如果研究温度对化学反应速率的影响,使用实验 ______ 和 ______ .
(3)甲同学在做A组实验时,发现反应开始时速率较慢,随后加快.他分析认为高锰酸钾与 草酸溶液的反应放热,导致溶液温度升高,反应速率加快;从影响化学反应速率的因素看,你猜想还可能是 ______ ;
Ⅱ.乙同学利用如图测定反应速率
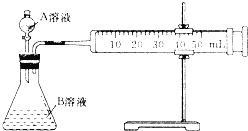
回答下列问题
(4)实验时要检查装置的气密性,简述操作的方法是 ______ ;
(5)乙同学通过生成相同体积的CO2来表示反应的速率,需要 ______ 仪来记录数据.