题目内容
15.某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )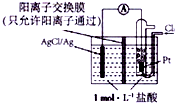
| A. | 正极为Pt电极,电极反应为2Ag++Cl2+2e-═2AgCl↓ | |
| B. | 放电时,交换膜两侧溶液中盐酸浓度不变 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
负极反应式为Cl-+Ag-e-=AgCl↓,正极反应式为Cl2+2e-═2Cl-,据此分析解答.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
负极反应式为Cl-+Ag-e-=AgCl↓,正极反应式为Cl2+2e-═2Cl-,据此分析解答.
A.正极为Pt电极,正极上氯气得电子,正极反应式为Cl2+2e-═2Cl-,故A错误;
B.负极反应式为Cl-+Ag-e-=AgCl↓,正极反应式为Cl2+2e-═2Cl-,氢离子会通过阳离子交换膜移至右侧,所以放电时左边盐酸浓度降低、右边升高,故B错误;
C.电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中共约减少0.02mol离子,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确正负极上发生的反应是解本题关键,难点是D选项,忽略银离子和氯离子的反应而导致错误,为易错点.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
6.如图1和图2是A、B两种物质的核磁共振氢谱.请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
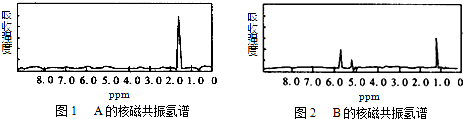

| A. | A是C3H6、B是C2H6 | B. | A是C6H6、B是C4H6 | C. | A是C6H6、B是C2H6 | D. | A是C3H8、B是C6H6 |
3.将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
10.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为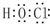 .
.
回答下列问题:
(1)A在周期表中的位置是第一周期IA族,写出实验室制备单质F的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为ADF |
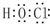 .
.
20.中国古代四大发明之一的黑火药,它的爆炸反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑,当发生上述反应时,2molKNO3可氧化木炭的物质的量是( )
| A. | 3mol | B. | 2.5mol | C. | 1mol | D. | 0.5mol |
4.食品安全、资源充分利用、保护环境备受关注,下列做法与此理念相违背的是( )
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
1.下述实验不能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol/LAgNO3溶液的试管中滴加0.1 mol/NaCl容液,至不再有沉淀生成,再向其中滴加0.lmol/LNa2S 溶液 | 证明在相同温度下,溶解度:AgCl>Ag2S |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO2溶液中存在水解平衡 |
| C | 分别向2mL甲苯、2mL苯、2niL正己烷中加入 3滴酸性高锰酸钾溶液,振荡,甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 取两只试管,分别加入4mL0.01mol/L KMn04酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4液4mL记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
2.下列反应的离子方程式正确的是( )
| A. | 将铜片投入足量稀硝酸中:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| B. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 硫酸溶液与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与 CuSO4溶液反应:2Na+Cu2+═2Na++Cu |
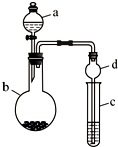 某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题:
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题: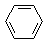 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$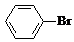 +HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.
+HBr.向c中滴加AgNO3溶液,可观察到的现象是产生浅黄色沉淀.