题目内容
18.核内中子数为N的某粒子R3+中,质量数为A,则n克它的氯化物中所含有的电子的物质的量为(Cl:核电荷数17,元素的相对原子质量为35.5)( )| A. | (A-N+3)mol | B. | $\frac{n}{A+106.5}$(A-N+51)mol | ||
| C. | $\frac{n}{A+35.5}$(A-N+51)mol | D. | $\frac{n}{A+106.5}$(A-N+47)mol |
分析 R的中子数为N,质量数为A,则R原子含有的电子数为A-N,形成的氯化物为RCl3,相对分子质量为A+3×35.5=A+106.5,电子数为A+17×3=A-N+51,结合n=$\frac{n}{M}$计算.
解答 解:R的中子数为N,质量数为A,则R原子含有的电子数为A-N,形成的氯化物为RCl3,相对分子质量为A+3×35.5=A+106.5,
n克它的氯化物的物质的量为$\frac{n}{A+106.5}$mol,
每个RCl3分子含有电子数为A+17×3=A-N+51,
则ng氯化物含有的电子数为$\frac{n}{A+106.5}$mol×(A-N+51).
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握原子的构成特点以及相关计算公式的运用,难度不大.

练习册系列答案
相关题目
9.下列各组物质中所含氧原子的物质的量相同的是( )
| A. | 0.3mol O2和0.3mol H2O | |
| B. | 6.02×1023个CO2与0.1mol KMnO4 | |
| C. | 0.1mol CuSO4•5H2O和0.1mol C6H2O6 | |
| D. | 0.1mol H2SO4和0.4NA个H2O |
6.欲除去KNO3溶液中的Fe3+,Mg2+,Ca2+,SO${\;}_{4}^{2-}$,加入的试剂先后顺序是( )
| A. | KOH、Ba(NO3)2、K2CO3、HNO3 | B. | Ba(NO3)2、K2CO3、HNO3、KOH | ||
| C. | KOH、K2CO3、Ba(NO3)2、HNO3 | D. | K2CO3、KOH、Ba(NO3)2、HNO3 |
13.与6g尿素[CO(NH2)2]含氮物质的量不相同的物质是( )
| A. | 3.4g NH3 | B. | 0.1mol NH4NO3 | C. | 6g NH4NO3 | D. | 13.2g (NH4)2SO4 |
3.钙与钠性质相似,也能形成过氧化物,则下列叙述正确的是( )
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠和过氧化钙的混合物中,阴影离子数个数比为1:2 | |
| C. | 过氧化钙与足量水反应生成0.5mol氧气时,转移的电子数为2NA | |
| D. | 过氧化钠和过氧化钙都可作漂白剂 |
18.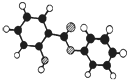 萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
 萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )
萨罗(Salol)是一种消毒剂,为芳香族化合物,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).则下列说法不正确的是( )| A. | 萨罗的分子式为C13H10O3 | |
| B. | 1mol萨罗与浓溴水反应,需要消耗3mol Br2 | |
| C. | 1mol萨罗发生水解,需要消耗3mol NaOH | |
| D. | 萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸) |