题目内容
6.欲除去KNO3溶液中的Fe3+,Mg2+,Ca2+,SO${\;}_{4}^{2-}$,加入的试剂先后顺序是( )| A. | KOH、Ba(NO3)2、K2CO3、HNO3 | B. | Ba(NO3)2、K2CO3、HNO3、KOH | ||
| C. | KOH、K2CO3、Ba(NO3)2、HNO3 | D. | K2CO3、KOH、Ba(NO3)2、HNO3 |
分析 除去KNO3溶液中的Fe3+、Mg2+、Ca2+、SO42-,可选KOH除去铁离子、镁离子,碳酸钾除去钙离子,硝酸钡除去硫酸根离子,碳酸钾一定在硝酸钡之后,以此来解答.
解答 解:因除杂试剂要过量,则先加Ba(NO3)2除去钡离子(或先加KOH除去Fe3+、Mg2+),然后加碳酸钾除去过量钡离子及钙离子,再加KOH除去Fe3+、Mg2+,最后加硝酸将过量的碳酸钾、KOH反应掉,即加入的试剂先后顺序是KOH、Ba(NO3)2、K2CO3、HNO3,或Ba(NO3)2、K2CO3、KOH、HNO3,
故选A.
点评 本题考查混合物分离提纯实验,为高频考点,把握除杂选择的试剂及试剂的先后顺序为解答的关键,注意碳酸钾一定在硝酸钡之后可除去过量的钡离子,题目难度不大.

练习册系列答案
相关题目
14.已知键能数据:1mol H-N:390.8kJ/mol;1mol N≡N:946kJ/mol;1mol H-H:436.0kJ/mol对反应3H2+N2═2NH3,其反应热的表述正确的是( )
| A. | △H=-600.4kJ/mol | B. | △H=-1081.6kJ/mol | ||
| C. | △H=+90.8kJ/mol | D. | △H=-90.8kJ/mol |
1.下列离子方程式书写正确的是( )
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 在硫酸氢钾溶液中加入氢氧化钡溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ |
18.核内中子数为N的某粒子R3+中,质量数为A,则n克它的氯化物中所含有的电子的物质的量为(Cl:核电荷数17,元素的相对原子质量为35.5)( )
| A. | (A-N+3)mol | B. | $\frac{n}{A+106.5}$(A-N+51)mol | ||
| C. | $\frac{n}{A+35.5}$(A-N+51)mol | D. | $\frac{n}{A+106.5}$(A-N+47)mol |
15.将盛有12mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积和剩余的2mL气体分别是( )
| A. | 1.2mL,NO | B. | 2.4mL,O2 | C. | 3.5mL O2 | D. | 4mL,NO |
6.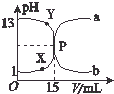 如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )
如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )
 如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )
如图曲线a和b是盐酸与氧氧化钠溶液在常温下的相互滴定的滴定曲线,下列叙述中正确的是( )| A. | 盐酸的物质的量浓度为1 mol•L-1 | |
| B. | P点时反应恰好完成,溶液呈中性,但它不是滴定终点 | |
| C. | X点时c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| D. | Y点时溶液呈碱性,溶液中c(H+)•c(OH-)>1×10-14 |
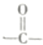 .根据上述信息,回答下列问题:
.根据上述信息,回答下列问题: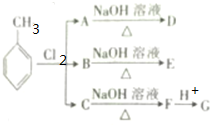
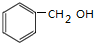 .
.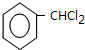 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$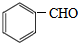 +2NaCl+H2O.
+2NaCl+H2O.