题目内容
11.请回答:(1)H2O2的电子式
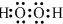 .
.(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C.
(3)完成以下氧化还原反应的离子方程式:2MnO-4+5C2O2-4+16H+=2Mn2++10CO2↑+8H2O.
分析 (1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)镁与二氧化碳反应生成碳与氧化镁,碳能够燃烧;
(3)反应中Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律配平书写方程式.
解答 解:(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为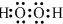 ,故答案为:
,故答案为: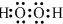 ;
;
(2)镁与二氧化碳反应生成碳与氧化镁,化学方程式:2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C,碳能够燃烧,所以镁燃烧不能用CO2灭火;
故答案为:2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C;
(3)Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,要想使氧化剂得到电子数等于还原剂失去电子数,则高锰酸根离子系数为2,草酸根离子系数为5,依据原子个数守恒,反应的方程式:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O;
故答案为:2;5;16H+;2;10;8H2O;
点评 本题考查了电子式、化学方程式的书写,氧化还原方程式配平,明确双氧水结构、镁的化学性质、氧化还原反应得失电子守恒规律是解题关键,侧重考查学生分析问题、解决问题能力,题目难度不大.

练习册系列答案
相关题目
19.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;T1温度下的部分实验数据为:
下列说法不正确的是( )
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K2=125,1 000 s时N2O5转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
20.下列有关叙述正确的是( )
| A. | pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1 | |
| B. | NH4HSO4液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2 c(SO42-) | |
| C. | 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw | |
| D. | pH相等的四种溶液:a.CH3COONa;b.Na2CO3;c.NaHCO3;d.NaOH,其溶液物质的量浓度由小到大顺序为d、b、a、c |
1.(1)化学与人类生产、生活密切相关.请按要求回答下列问题:
①下列我国古代的技术应用中,其工作原理不涉及化学反应的是C(填字母)
②下列用品的有效成分及用途对应错误的是B(填字母)
③工业上常用氯气和石灰乳反应生产漂白粉,其原理是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(用化学方程式表示).
④在生产中,人们曾用浓氨水来检验氯气管道是否漏气.如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为8NH3 +3Cl2=N2+6NH4Cl.
(2)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究.物质分类及转化思想贯穿整个化学科学习的始终.
①有下列十种物质:A.空气 B.O2 C.NaHSO4 D.氨水E.CuSO4•5H2O F.NaOHG.CO2 H.Fe2O3 I.金刚石 J.H2SO4.
其中属于混合物的有AD;属于单质的有BI;属于盐的有CE.(填字母)
②有下列六个反应:
A.Cl2+H2O═HCl+HClO
B.Zn+H2SO4═ZnSO4+H2↑
C.2Cu2O+Cu2S═6Cu+SO2↑
D.Cl2+2KI═2KCl+I2
E.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl
F.2KClO3$\frac{\underline{\;MnO_{2}△\;}}{\;}$2KCl+3O2↑
其中属于置换反应的是BD,既属于分解反应又属于氧化还原反应的是F(填字母).
③K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0~30℃\;}}{\;}$2K2FeO4+6KCl+8H2O在该反应中,还原剂是Fe(OH)3,当反应中有1mol K2FeO4生成时,转移电子的数目为3×6.02×1023.
(3)物质的量是化学计算的核心.请按要求完成下列填空:
①已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是16g/mol.
②含0.4mol Al3+的Al2O3的质量是20.4g.
③某块光卤石(KCl•MgCl2•6H2O)中含5.3250g Cl-,则该光卤石的物质的量为0.05mol.
④标准状况下,224mL的氨气中含有的氢原子数为0.03×6.02×1023.
①下列我国古代的技术应用中,其工作原理不涉及化学反应的是C(填字母)
| 火药使用 | 粮食酿酒 | 转轮排字 | 铁的冶炼 |
 |  |  |  |
| 用品 |  |  |  |  |
| 有效成分 | NaCl | NaOH | NaHCO3 | Ca(ClO)2 |
| 用途 | 做调味品 | 做治疗胃病的抗酸药 | 做发酵粉 | 做消毒剂 |
④在生产中,人们曾用浓氨水来检验氯气管道是否漏气.如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为8NH3 +3Cl2=N2+6NH4Cl.
(2)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究.物质分类及转化思想贯穿整个化学科学习的始终.
①有下列十种物质:A.空气 B.O2 C.NaHSO4 D.氨水E.CuSO4•5H2O F.NaOHG.CO2 H.Fe2O3 I.金刚石 J.H2SO4.
其中属于混合物的有AD;属于单质的有BI;属于盐的有CE.(填字母)
②有下列六个反应:
A.Cl2+H2O═HCl+HClO
B.Zn+H2SO4═ZnSO4+H2↑
C.2Cu2O+Cu2S═6Cu+SO2↑
D.Cl2+2KI═2KCl+I2
E.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl
F.2KClO3$\frac{\underline{\;MnO_{2}△\;}}{\;}$2KCl+3O2↑
其中属于置换反应的是BD,既属于分解反应又属于氧化还原反应的是F(填字母).
③K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0~30℃\;}}{\;}$2K2FeO4+6KCl+8H2O在该反应中,还原剂是Fe(OH)3,当反应中有1mol K2FeO4生成时,转移电子的数目为3×6.02×1023.
(3)物质的量是化学计算的核心.请按要求完成下列填空:
①已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是16g/mol.
②含0.4mol Al3+的Al2O3的质量是20.4g.
③某块光卤石(KCl•MgCl2•6H2O)中含5.3250g Cl-,则该光卤石的物质的量为0.05mol.
④标准状况下,224mL的氨气中含有的氢原子数为0.03×6.02×1023.

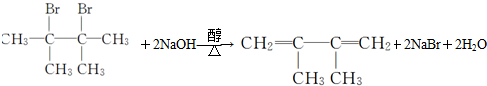 .
.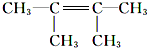 ;G的结构简式
;G的结构简式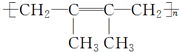 .F1和F2互为同分异构体.
.F1和F2互为同分异构体.
 .
.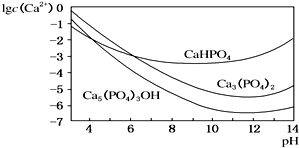 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种: (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.