题目内容
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
CO与N2中化学性质较活泼的是 ;结合数据说明原因 。
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN-形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是 。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3-互为等电子体的分子 (写出一种)。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN-形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是 。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3-互为等电子体的分子 (写出一种)。
(1)
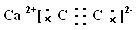 (2)sp2杂化 sp1杂化 2︰1;(3)5;
(2)sp2杂化 sp1杂化 2︰1;(3)5;(4)CO CO第一个π键键能比N2中第一个π键键能小,易断裂,发生反应
(5)C、 E;(6)SO3
试题分析:(1)CaC2为离子化合物,在C22-离子中阴离子中的2个C原子间共用三对电子,因此CaC2的电子式为
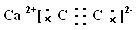 ;在CH2=CH—CN中C原子的杂化方式前两个C原子是sp2杂化最后一个C是sp1杂化;分子中σ键是6个,π键数是3个,因此分子中σ键和π键数之比为2:1;(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,由于Fe的价电子排布式是3d64s2,价电子是8,而每个配位体CO提供2的电子,因此配位数是5.即n=5;(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O,由于CO第一个π键键能比N2中第一个π键键能小,易断裂,发生反应,所以CO与N2中化学性质较活泼的是N2. (5)K4[Fe(CN)6]和K3[Fe(CN)6]晶体都是离子晶体,在晶体中存在离子键、共价键、配位键,不存在金属键和分子间作用力。因此选项为C、 E;(6)与NO3-互为等电子体的分子是SO3 。
;在CH2=CH—CN中C原子的杂化方式前两个C原子是sp2杂化最后一个C是sp1杂化;分子中σ键是6个,π键数是3个,因此分子中σ键和π键数之比为2:1;(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,由于Fe的价电子排布式是3d64s2,价电子是8,而每个配位体CO提供2的电子,因此配位数是5.即n=5;(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O,由于CO第一个π键键能比N2中第一个π键键能小,易断裂,发生反应,所以CO与N2中化学性质较活泼的是N2. (5)K4[Fe(CN)6]和K3[Fe(CN)6]晶体都是离子晶体,在晶体中存在离子键、共价键、配位键,不存在金属键和分子间作用力。因此选项为C、 E;(6)与NO3-互为等电子体的分子是SO3 。
练习册系列答案
相关题目


 回答下列问题:
回答下列问题:
 与
与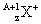 的两种微粒,下列叙述正确的是( )
的两种微粒,下列叙述正确的是( )
 的质子数和中子数相等
的质子数和中子数相等 X+2WZ
X+2WZ