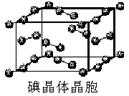
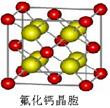
题目内容
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:①>② | B.原子半径:④>③ |
| C.电负性: ②>③ | D.氢化物稳定性:①>② |
D
试题分析:①是S;②是P;③N;④是F。A.一般情况下,同一周期的元素,原子序数越大,原子半径越小,第一电离能就越大。但是当原子核外 电子在轨道上处于全充满、半充满或全空时是稳定的,失去电子较难,第一电离能较大。因此第一电离能:②>①。错误。B.N、F是同一周期的元素,原子序数越大,原子半径就越小。因此原子半径:③>④。错误。C.元素的非金属性越强,其电负性就越大。非金属性N>P,所以电负性:③>②。错误。D.元素的非金属性越强,其简单的氢化物的稳定性就越强,非金属性S>P氢化物稳定性:①>②。周期。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
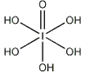 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)