题目内容
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.放电时转移3 mol e-,有2 mol FeO42-被还原 |
D
解析

练习册系列答案
相关题目
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:N2(g)+2O2(g)=2NO2(g) ΔH="+67.7kJ/mol," 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5+ + OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
镀锌钢管具有广泛的用途,镀锌钢管有冷镀锌管和热镀锌管,冷镀即电镀,热镀是指熔融状态的锌与铁生成合金层。下列说法正确的是
| A.铁锌形成的合金层是纯净物,耐酸碱腐蚀 |
| B.钢管镀锌的目的是使铁与锌形成原电池,消耗锌而保护钢管免受腐蚀 |
| C.钢管冷镀时,钢管作阴极,锌棒作阳极,锌盐溶液作电解质溶液 |
| D.镀锌钢管破损后,负极反应式为Fe-2e-=Fe2+ |
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是 ( )
Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是 ( )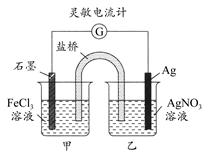
| A.反应开始时,石墨棒作阳极,银棒作阴极 |
| B.灵敏电流计的读数由小变大,再变小 |
| C.反应达化学平衡时,电流计读数最小 |
| D.反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又将偏转 |
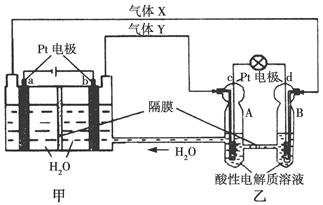
到2013年我国将完成神九、神十与“天宫一号”的交会对接,为将来建立空间站作准备。下图是空间站能量转化系统的局部示意图,其中该燃料电池采用KOH溶液为电解质溶液,下列有关说法错误的是( )
光电转化器→水电解系统→氢氧储罐→燃料电池系统
| A.该能量转化系统中的水是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于太阳能 |
| C.水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ |
| D.燃料电池放电时的正极反应:H2-2e-+2OH-=2H2O |
如图所示的装置中铁棒上析出铜,而铁的质量不变,符合要求的原电池是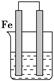
| A.铁棒作负极,铜棒作正极,电解质溶液是CuSO4溶液 |
| B.镁棒作负极,铁棒作正极,电解质溶液是CuSO4溶液 |
| C.镁棒作负极,铁棒作正极,电解质溶液是FeCl3溶液 |
| D.铁棒作负极,铜棒作正极,电解质溶液是H2SO4溶液 |
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电极总反应式为2H2+O2=2H2O;电解质溶液为KOH溶液,反应保持在较高温度,使水蒸发,下列叙述正确的是
| A.此电池能见到浅蓝色火焰 |
| B.H2为正极,O2为负极 |
| C.工作时电解液的OH-的物质的量不断增加 |
| D.电极反应为负极H2失电子;正极O2得电子 |
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是 ( )。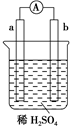
| A.碳棒上有气体放出,溶液pH变大 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子从a极到b极 |
| D.a极上发生了氧化反应 |