题目内容
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是 ( )
Fe2++Ag+设计成如图所示的原电池。下列判断不正确的是 ( )
| A.反应开始时,石墨棒作阳极,银棒作阴极 |
| B.灵敏电流计的读数由小变大,再变小 |
| C.反应达化学平衡时,电流计读数最小 |
| D.反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又将偏转 |
A
解析

练习册系列答案
相关题目
以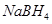 (B元素的化合价为+3)和
(B元素的化合价为+3)和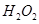 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为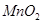 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是
| A.该电池工作时Na+由a极区移向b极区 |
| B.电极b是原电池的正极 |
C.该电池的负极反应为: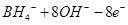 = =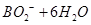 |
D.电路中通过6.02×1022个电子时,理论上消耗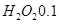 mol mol |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )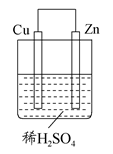

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺——TiO2直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。下列说法错误的是 ( )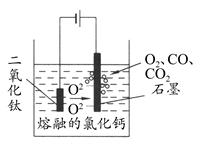
| A.阴极得到钛,电极反应式为TiO2+4e-=Ti+2O2- |
| B.阳极的电极反应式是2O2--4e-=O2↑,生成的部分氧气会将石墨氧化成CO和CO2 |
| C.在工业生产过程中应该不断地更换两极材料 |
| D.该法生产Ti符合绿色环保的要求 |
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )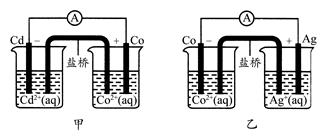
| A.甲图电池反应的离子方程式为:Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq) |
| B.2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)反应能够发生 |
| C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性 |
| D.乙图当有1 mol电子通过外电路时,正极有108 g Ag析出 |
下列防腐措施中,属于化学保护法的为 ( )。
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的船壳吃水线以下部分,装上锌块 |
| D.金属表面喷漆 |
关于铅蓄电池的说法正确的是 ( )。
| A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s) |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.放电时转移3 mol e-,有2 mol FeO42-被还原 |