题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 1 mol Na与O2反应,生成Na2O和Na2O2的混合物共失去NA个电子
C. 1mol Na2O2固体中含有离子总数为4NA
D. 25℃时,pH=13的氢氧化钠溶液中约含有NA个氢氧根离子
【答案】B
【解析】
A、P4和甲烷空间结构都是正四面体,P4的空间结构是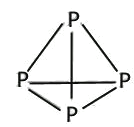 ,1mol白磷中有6molP-P键,甲烷的空间结构为
,1mol白磷中有6molP-P键,甲烷的空间结构为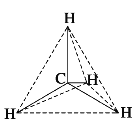 ,1mol甲烷中4molC-H键,0.4NA共价键,当含有共价键的物质的量为0.4mol时,白磷的物质的量为0.4/6mol,甲烷的物质的量为0.4/4mol,故A错误;
,1mol甲烷中4molC-H键,0.4NA共价键,当含有共价键的物质的量为0.4mol时,白磷的物质的量为0.4/6mol,甲烷的物质的量为0.4/4mol,故A错误;
B、无论是Na2O还是Na2O2,Na的化合价为+1价,1molNa都失去电子1mol,数目为NA,故B 正确;
C、由Na2O2的电子式 可知,1molNa2O2固体中含有离子总物质的量为3mol,个数为3NA,故C错误;
可知,1molNa2O2固体中含有离子总物质的量为3mol,个数为3NA,故C错误;
D、题中未给出溶液的体积,无法计算OH-的物质的量,故D错误,答案选B。

【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1) C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)![]() 2CO(g) ΔH2=+172.5 kJ·mol-1
2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)![]() SO2(g) ΔH3=-296.0 kJ·mol-1
SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:_________________。
(2)关于CO还原SO2的反应,下列说法正确的是______。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增大SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ/mol
N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol
N2(g)+2CO2(g) ΔH=-64.2kJ/mol
(3)对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,NO的平均反应速率v(NO)=___________,当升高反应温度,该反应的平衡常数K___________(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因_____________;在1100kPa时,NO2的体积分数为___________。
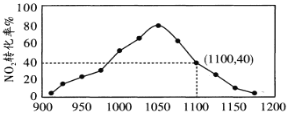
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=___________(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。