题目内容
7.某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种.为检验其中含有的离子,进行如下实验:①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | SO42-、SO32-至少含有一种 | |
| C. | 是否存在Na+需要通过焰色反应来确定 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |
分析 无色溶液中不存在有色的Cu2+;
①取10mL溶液,加入足量氯水,无气体产生,说明原溶液中不存在CO32-,再加入CCl4溶液分层,下层为橙红色,说明存在Br-;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g,该沉淀为硫酸钡,说明原溶液中含有SO42-、SO32-中的至少一种离子,则一定不存在Ba2+;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体,说明原溶液中含有NH4+,据此结合电荷守恒进行解答.
解答 解:无色溶液中不存在有色的Cu2+;根据①加入足量氯水生成无气体产生可知原溶液中不存在CO32-,再加入CCl4溶液分层,下层为橙红色,说明存在Br-;
将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g,该沉淀为硫酸钡,说明原溶液中含有SO42-、SO32-中的至少一种离子,则一定不存在Ba2+;
根据③可知生成的气体为氨气,其物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,说明原溶液中含有0.02molNH4+;
2.33g硫酸钡的物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,由于溶液中含有溴离子,根据电荷守恒可知原溶液中负电荷的物质的量一定大于0.02mol,而正电荷只有0.02mol,说明溶液中一定还含有Na+,
根据分析可知,溶液中一定含有的离子为:Na+、NH4+、Br-及SO42-、SO32-中的至少一种离子;一定不存在的离子为:Ba2+、Cu2+、CO32-,不能确定的离子为Cl-,
A.肯定存在NH4+、Br-,无法确定是否含有Cl-,故A错误;
B.根据分析可知,SO42-、SO32-至少含有一种,故B正确;
C.根据分析可知,溶液中一定含有钠离子,不需要通过焰色反应检验,故C错误;
D.肯定不存在Ba2+、Cu2+、CO32-,可能含有SO32-,故D错误;
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,根据电荷守恒判断钠离子的存在情况为解答关键,试题培养了学生的分析能力及逻辑推理能力.

| A. | Mg3N2晶体中的化学键是共价键 | |
| B. | 某物质含有离子键,则该物质在任何条件下均能导电 | |
| C. | 干冰是分子晶体,其气化过程中只需克服分子间作用力 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
| A. | 0.1mol/L的蔗糖溶液 | B. | 0.1mol/L的CaCl2溶液 | ||
| C. | 0.2mol/L的NaCl溶液 | D. | 0.1mol/L的盐酸 |
| A. | 自然界的硫元素主要以硫单质、硫化物和硫酸盐等形式存在 | |
| B. | 浓硫酸可作干燥剂,但不能干燥二氧化硫、氯气等气体 | |
| C. | 二氧化硫能使溴水褪色,说明其具有漂白性 | |
| D. | 浓硫酸中存在的主要是硫酸分子,常温下就能和铜片剧烈反应 |
| A. | 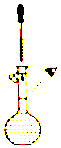 操作I导致配制溶液的物质的量浓度偏小 | |
| B. | 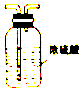 用装置II干燥氨气 | |
| C. | 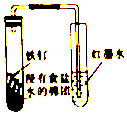 实验Ⅲ可观察铁钉的吸氧腐蚀 | |
| D. |  实验Ⅳ记录的读数为12.20mL |
| A. | 反应进行60s时,X、Y、Z的浓度相等 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 以X浓度变化表示的反应速率为0.06mol/(L•min) | |
| D. | 反应进行80s时,Y物质的量浓度为0.03mol/L |
| A. | 为防止水解,FeCl3溶液中加入少量稀硫酸 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
 .
.