题目内容
18.下列说法正确的是( )| A. | Mg3N2晶体中的化学键是共价键 | |
| B. | 某物质含有离子键,则该物质在任何条件下均能导电 | |
| C. | 干冰是分子晶体,其气化过程中只需克服分子间作用力 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
分析 A.Mg3N2晶体中Mg2+与N3-形成离子键;
B.含有离子键的物质,在固态时不能电离出自由移动的离子;
C.干冰是分子晶体存在分子间作用力;
D.氢气中H原子最外层只有2个电子.
解答 解:A.Mg3N2晶体中Mg2+与N3-形成离子键,不存在共价键,故A错误;
B.含有离子键的物质,在固态时不能电离出自由移动的离子,所以固态离子化合物不能导电,故B错误;
C.干冰是分子晶体存在分子间作用力,所以二氧化碳的气化过程中只需克服分子间作用力,故C正确;
D.氢气中H原子最外层只有2个电子,属于2个电子的稳定结构,故D错误.
故选C.
点评 本题考查了化学键、分子间作用力、8电子稳定结构,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握8电子稳定结构的判断方法.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
8.下列属于酸性氧化物的是( )
| A. | 水 | B. | 一氧化碳 | C. | 氧化钠 | D. | 二氧化硫 |
9.下列物质的制备操作,可以达到实验目的是( )
| A. | 向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体 | |
| B. | 用铁和Cl2加热制取FeCl3 | |
| C. | 用铜粉和硫粉混合加热制备CuS | |
| D. | 向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3 |
13.下列表示正确的是( )
| A. | CO2的电子式: | B. | 乙烯的结构式:CH2═CH2 | ||
| C. | CH4的比例模型: | D. | Cl-离子的结构示意图: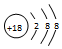 |
7.某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | SO42-、SO32-至少含有一种 | |
| C. | 是否存在Na+需要通过焰色反应来确定 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |
13.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
| A. | 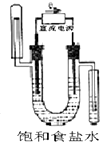 氢氧化钠溶液 | B. | 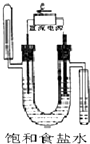 淀粉碘化钾溶液 | C. |  氢氧化钠溶液 | D. | 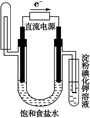 淀粉碘化钾溶液 |
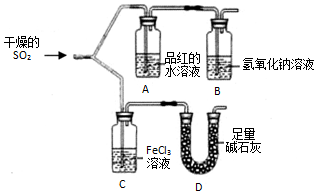 如图装置进行SO2气体性质实验.
如图装置进行SO2气体性质实验.