题目内容
17.现有200mL混合溶液,其中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)(1)滴入少量氯水时被氧化的元素是I,氧化产物是I2(填化学式).
(2)若有0.15mol Cl2被还原,则所得溶液中含有的阴离子主要是Br-、Cl-.
(3)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为0.25mol,若最终所得溶液为400mL,其中主要阳离子的物质的量浓度为0.5mol/L.
(4)往上述反应后的溶液中滴入淀粉溶液,溶液变蓝. 继续滴入过量氯水,蓝色褪去,试写出有关反应的离子方程式并分析电子转移情况:
 .
.
分析 还原能力强弱顺序为I->Fe2+>Br-,则逐滴滴入氯水,则先后发生:Cl2+2I-=2Cl-+I2、Cl2+2Fe2+=2Fe3++2Cl-、Cl2+2Br-=2Cl-+Br2,结合对应物质的物质的量判断反应的程度,并结合反应的离子方程式计算.
解答 解:(1)还原能力强弱顺序为I->Fe2+>Br-,则滴入少量氯水时被氧化的元素是I,发生反应Cl2+2I-=2Cl-+I2,则氧化产物为I2,故答案为:I;I2;
(2)现有200mL混合溶液,其中含FeI2、FeBr2各0.10mol,则n(I-)=0.2mol,n(Fe2+)=0.2mol,若氯水中有0.15mol Cl2被还原,则主要发生Cl2+2I-=2Cl-+I2,Cl2+2Fe2+=2Fe3++2Cl-,由离子方程式可知I-全部被氧化,有0.1molFe2+被氧化,则所得溶液中含有的阴离子主要是Br-、Cl-,故答案为:Br-、Cl-;
(3)若原溶液中Br-有一半被氧化,则
Cl2+2I-=2Cl-+I2,
0.1 0.2
Cl2+2Fe2+=2Fe3++2Cl-,
0.1 0.2
Cl2+2Br-=2Cl-+Br2,
0.05 0.1
共消耗Cl2的物质的量为(0.1|+0.1+0.05)mol=0.25mol,
溶液中主要阳离子为Fe3+,物质的量为0.2mol,浓度为c(Fe3+)=$\frac{0.2mol}{0.4L}$=0.5mol/L,
故答案为:0.25mol;0.5mol/L;
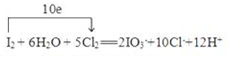
(4)往上述反应后的溶液中滴入淀粉溶液,溶液变蓝. 继续滴入过量氯水,蓝色褪去,说明氯气将碘单质氧化生成碘酸根,离子方程式为:5Cl2+I2+6H2O=2 IO3-+12H++10Cl-,转移电子数为10,则单线桥法表示为
故答案为: .
.
点评 本题考查氯气的性质以及方程式的计算,注意根据离子的还原性判断反应的先后顺序,为解答该题的关键,注意结合反应的离子方程式解答该题,难度中等.

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
| A. | 水 | B. | 一氧化碳 | C. | 氧化钠 | D. | 二氧化硫 |
| A. | 取样品mg,配成100ml溶液,取25.00mL于锥形瓶中,滴加几滴石蕊试液,用浓度为cmol/L的标准盐酸滴定至终点时,消耗盐酸Vml | |
| B. | 取样品mg,充分加热,冷却,称量固体的质量为n1g | |
| C. | 取样品mg,滴加足量的BaCl2溶液,过滤,洗涤,于燥后称量固体的质量为n2g | |
| D. | 取样品mg,滴加足量的Ba(OH)2过滤,洗涤,干燥后称量固体的质量为n3g |

| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为醋酸,B为碳酸钙,C中盛澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀,后沉淀又溶解 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |
| A. | 向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体 | |
| B. | 用铁和Cl2加热制取FeCl3 | |
| C. | 用铜粉和硫粉混合加热制备CuS | |
| D. | 向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3 |
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | SO42-、SO32-至少含有一种 | |
| C. | 是否存在Na+需要通过焰色反应来确定 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |