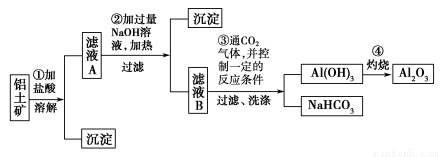
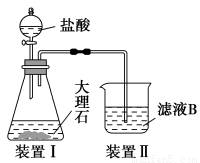
题目内容
已知:H2A的A2-可表示S2-、SO42—、SO32—、SiO32—或CO32—。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
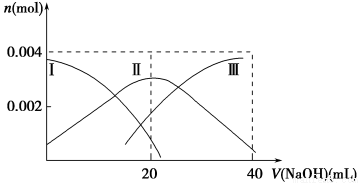
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入_______________________________________________________。
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1 011.0 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
则反应③Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH3=________ kJ·mol-1。工业上制备Na2S时往往还要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热,维持反应③所需温度;其二是________________________________________。
(3)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
(1)①c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) ②小 碱 (2)+569.0 使硫酸钠得到充分还原(或提高Na2S产量) (3)10-13
【解析】(1)①由题图可知,当氢氧化钠溶液的体积为20 mL时,c(HA-)>
c(A2-)>c(H2A),则NaHA溶液中,HA-电离程度大于水解程度。②等体积等浓度的氢氧化钠溶液和H2A溶液混合,相当于得到NaHA溶液,由第①小问知,NaHA溶液显酸性,所以其水溶液中水的电离受到抑制,小于纯水的电离程度,向其中加入碱可使其呈中性。
(2)根据盖斯定律,由①+②×2=③可得ΔH3=+569.0 kJ·mol-1。
(3)根据KW的定义,KW=c(H+)·c(OH-),由于pH=2的稀硫酸和pH=11的氢氧化钠溶液等体积混合后溶液呈中性,即稀硫酸中的c(H+)和氢氧化钠溶液中的c(OH-)都为10-2 mol·L-1,在t ℃时,氢氧化钠溶液中,c(H+)=
10-11 mol·L-1、c(OH-)=10-2 mol·L-1,所以KW=10-13。

 阅读快车系列答案
阅读快车系列答案孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
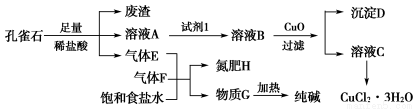
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
金属离子 | Fe3+ | Fe2+ | Cu2+ | |
pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。