题目内容
(14分)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
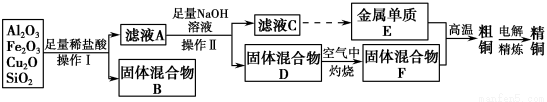
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为_______________________________________________
________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_____________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→______________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
(1)过滤 坩埚
(2)Fe2+2Fe3++Cu=2Fe2++Cu2+ 硫氰化钾溶液和新制氯水(合理的氧化剂均正确)
(3)2Al+Fe2O3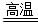 Al2O3+2Fe
Al2O3+2Fe
(4)11
(5)①bc ②将浓硫酸用蒸馏水稀释,将称得的样品与足量稀硫酸充分反应
【解析】由流程图可以看出,加入足量稀盐酸时,得到的固体混合物B为二氧化硅和单质铜,则滤液A中一定不含Fe3+,原因是2Fe3++Cu=2Fe2++
Cu2+,验证Fe2+可先加入KSCN溶液,没有明显现象,再加入氯水(或其他氧化剂)出现红色。滤液A中含有Fe2+、Al3+、Cu2+,加入足量NaOH溶液后得到的固体混合物D为Fe(OH)3和Cu(OH)2,在空气中灼烧后得到的固体混合物F为Fe2O3和CuO,滤液C中含AlO2—,则金属单质E为Al,利用铝热反应可焊接钢轨。
(4)NaAlO2溶液中水的电离受到促进,而NaOH溶液中水的电离受到抑制。设两种溶液的pH=a,NaAlO2溶液中水电离出的c(OH-)为10a-14 mol·L-1,NaOH溶液中水电离出的c(OH-)为10-a mol·L-1,10a-14=108×10-a,得a=11。(5)电解精炼铜时,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解液,粗铜中比铜活泼的金属进入电解质溶液。分析选项知,b、c正确。

T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
时间/min | c(H2)/mol·L-1 | c(CH3OH)/mol·L-1 | v(正)和v(逆)比较 |
t0 | 6 | 0 | ? |
t1 | 3 | 1 | v(正)=v(逆) |
A.t0~t1时间内v(H2)=3/(t1-t0) mol·L-1·min-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T ℃时,平衡常数K=1/27,CO2与H2的转化率相等