题目内容
下列叙述正确的是
| A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 |
| B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>② |
| C.0.1mol?L-1的氨水加水稀释后,NH3?H2O的电离程度增大,c(OH-)增大,c(H+)减小 |
| D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存 |
A
解析试题分析:A、增大体系压强,I2的浓度增大,体系颜色加深但方程式两边气体分子数相同,平衡不移动,错误;B、NaOH是强碱,而CH3COONa、Na2CO3水解使溶液呈碱性,且越弱越水解,NaNO3是强酸强碱盐溶液定为中性,pH的大小顺序是④>③>①>②,正确;C、氨水加水稀释后,NH3?H20的电离程度增大,c(OH-)减小,c(H+)增大,错误;D、c(H+)/(OH-)=10-10,溶液呈碱性,Al3+不能存在,故错误。
考点:考查电解质溶液、化学平衡、离子共存。

一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | | | |
| t2 | | 0.20 | | |
B.平衡时水蒸气的转化率为66.67%
C.该温度下反应的平衡常数为l
D.其他条件不变,若起始时,n(CO)="0.60" mol,n(H2O)="1.20" mol,则平衡时水蒸气的转化率为33.33%
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g) xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )
xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )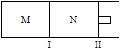
| A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
| B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
| C.若x<3,C的平衡浓度关系为:c(M)>c(N) |
| D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
下列判断错误的是
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当反应达到平衡时,容器中Cl2为1.2 mol
C.若升高温度反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后再加入2.0 mol PCl3,在相同条件下再达平衡时,c(PCl5)<1.0mol/L
在反应C(s)+CO2(g)=2CO(g)中,能使反应速率加快的是
①增大压强 ②升高温度 ③将C粉碎 ④通CO2气体 ⑤加入足量木炭粉
| A.①②③ | B.①②④ | C.①②③④ | D.全部 |
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是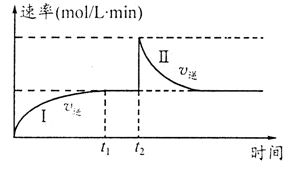
| A.0~t2时,v正>v逆 |
| B.t2时刻改变的条件可能是加催化剂 |
| C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
| D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |