题目内容
【题目】常温下,用0.1 mol/L的NaOH溶液滴定20 mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是

A.X=20
B.HA溶液加水稀释后,溶液中![]() 的值减小
的值减小
C.0.1 mol/L的NaOH溶液中,由水电离出的c(OH)=0.1 mol/L
D.加入NaOH溶液体积为X mL时,溶液中c(A)=0.05 mol/L
【答案】B
【解析】X点对应溶液pH=7,溶液呈中性,HA为弱酸,此时加入NaOH的体积小于HA溶液体积,所以X<20 mL,A项错误。HA为弱酸,存在电离平衡,加水稀释促进电离,HA物质的量减小,A物质的量增大,但c(HA)与c(A)均减小,c(HA)减小的程度更大,所以![]() 减小,B项正确。0.1 mol/L的NaOH溶液中,NaOH电离的OH抑制H2O的电离,H2O电离出的H+与OH浓度相等,即由水电离的c(OH)=c(H+)=
减小,B项正确。0.1 mol/L的NaOH溶液中,NaOH电离的OH抑制H2O的电离,H2O电离出的H+与OH浓度相等,即由水电离的c(OH)=c(H+)=![]() mol/L,C项错误。加入NaOH溶液体积为 X mL时,溶液呈中性,根据电荷守恒可得:c(Na+)=c(A),但加入NaOH的体积小于20 mL,所以c(A)<0.05 mol/L,D项错误。
mol/L,C项错误。加入NaOH溶液体积为 X mL时,溶液呈中性,根据电荷守恒可得:c(Na+)=c(A),但加入NaOH的体积小于20 mL,所以c(A)<0.05 mol/L,D项错误。

【题目】金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:

部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为__________。
(2)反应①、②、③、④中,发生氧化还原反应的是__________(填序号),写出反应①的离子方程式____。操作1、操作2用到的玻璃仪器是___________。
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,下图是反应温度与沉钒率的关系图,则控制温度的方法是_____________。

(4)反应④在焙烧过程中随温度的升高发生了两步反应。已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图。试写出300℃~350℃时反应的化学方程式___________。
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
VO2++H2O+V3+。电池充电时阳极的电极反应式为____________。
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备:
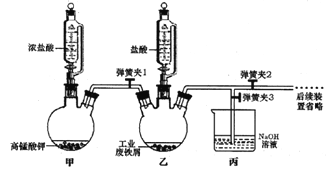
①实验过程中装置乙发生反应的离子方程式有________,仪器丙的作用为_________。
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为_______________。
③反应结束后,将乙中溶液边加入_____________,边进行加热浓缩、______、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
某兴趣小组将饱和FeC13溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeC13溶液浓度越大,水解程度越小 ②氯化铁的熔点为306℃、沸点为315℃ ,易升华,气态FeCl3会分解成FeCl2和Cl2③ FeC12熔点670℃)
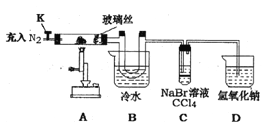
操作步骤 | 实验现象 | 解释原因 |
打开K , 充入氮气 | D中有气泡产生 | ①充入N2的原因________ |
关闭K, 加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________ |
实验结束,振荡C静置 | ③___________ | ④________________(用相关的方程式说明) |
⑤结合以上实验和文献资料,该固体可以确定的成分有______________________。 | ||