题目内容
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备:
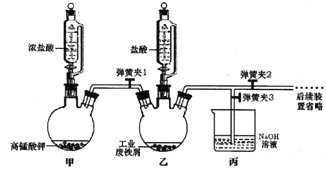
①实验过程中装置乙发生反应的离子方程式有________,仪器丙的作用为_________。
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为_______________。
③反应结束后,将乙中溶液边加入_____________,边进行加热浓缩、______、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
某兴趣小组将饱和FeC13溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeC13溶液浓度越大,水解程度越小 ②氯化铁的熔点为306℃、沸点为315℃ ,易升华,气态FeCl3会分解成FeCl2和Cl2③ FeC12熔点670℃)

操作步骤 | 实验现象 | 解释原因 |
打开K , 充入氮气 | D中有气泡产生 | ①充入N2的原因________ |
关闭K, 加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________ |
实验结束,振荡C静置 | ③___________ | ④________________(用相关的方程式说明) |
⑤结合以上实验和文献资料,该固体可以确定的成分有______________________。 | ||
【答案】 Fe+2H+=Fe2++H2↑ 、Cl2+2Fe2+=2Fe3++2Cl- 吸收多余的氯气 关闭弹簧夹1和3,打开弹簧夹2;待铁粉完全溶解后打开弹簧夹1和3,关闭弹簧夹2 浓盐酸 冷却结晶 排出装置内的空气 FeC13易升华 溶液分层,上层接近无色,下层橙红色 2FeCl3![]() 2FeCl2+Cl2 、2Br-+Cl2=Br2+2Cl- FeCl3、FeCl2、Fe2O3
2FeCl2+Cl2 、2Br-+Cl2=Br2+2Cl- FeCl3、FeCl2、Fe2O3
【解析】本题考查实验设计方案的评价,(1)①装置甲制取氯气,装置乙发生Fe+2H+=Fe2++H2↑,利用氯气的强氧化性,把Fe2+氧化成Fe3+,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-;氯气有毒,作为尾气必须除去,除去氯气常用氢氧化钠溶液,因此丙装置中盛放NaOH的作用是除去多余尾气;②为了实验顺利进行,铁和盐酸先充分反应,待铁全部溶解后,再通入氯气,因此操作是:关闭弹簧夹1和3,打开弹簧夹2,待铁粉完全溶解后,打开弹簧夹1和3,关闭弹簧夹2;③Fe3+易水解,为防止水解,边加入浓盐酸,边进行加热浓缩、冷却结晶、过滤;(2)①充入氮气的目的是排除装置中的空气,防止干扰实验;②棕黄色固体是FeCl3,根据信息,FeCl3易升华,A中FeCl3由固体转化成气体,在B装置中遇冷凝结为固体;③FeCl3受热分解成FeCl2和Cl2,Cl2与KBr反应生成Br2,Br2易溶于有机溶剂,现象是:溶液分层,上层接近无色,下层橙红色;④2FeCl3![]() 2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-;⑤根据上述现象和资料推出含有的物质是FeCl3、FeCl2、Fe2O3。
2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-;⑤根据上述现象和资料推出含有的物质是FeCl3、FeCl2、Fe2O3。