题目内容
17.下列化学用语表示正确的是( )| A. | 铝原子的结构示意图: | B. | 乙炔的比例模型: | ||
| C. | 水分子的电子式: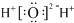 | D. | 硝基苯的结构简式: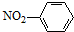 |
分析 A.铝原子的核电荷数=核外电子总数=13,最外层为3个电子;
B.乙炔分子中存在碳碳三键,为直线型结构;
C.水为共价化合物,分子中不存在阴阳离子;
D.硝基的书写不规范,应该为N与苯环碳相连.
解答 解:A.铝原子的核电荷数、核外电子总数都是13,其原子结构示意图为: ,故A正确;
,故A正确;
B.乙炔分子为直线型结构,其正确的比例模型为: ,故B错误;
,故B错误;
C.水是共价化合物,原子间通过共用电子对形成化学键,其正确的电子式为: ,故C错误;
,故C错误;
D.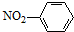 中硝基的连接方式错误,应该为N与苯环碳相连,正确的结构简式为:
中硝基的连接方式错误,应该为N与苯环碳相连,正确的结构简式为: ,故D错误;
,故D错误;
故选A.
点评 本题考查了结构简式、比例模型、原子结构示意图、电子式等化学用语的判断,题目难度中等,注意掌握常见化学用语的书写原则,试题有利于提高学生规范答题的能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
8.①制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
请回答下列问题:
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)配制成250mL溶液使用的量具是250mL容量瓶,指示剂还可用甲基橙;
(3)滴定终点的现象是浅红色溶液变为无色,30秒内不褪色.
(4)滤液中溶质的物质的量浓度为0.1250 mol L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)配制成250mL溶液使用的量具是250mL容量瓶,指示剂还可用甲基橙;
(3)滴定终点的现象是浅红色溶液变为无色,30秒内不褪色.
(4)滤液中溶质的物质的量浓度为0.1250 mol L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
2.下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
| A. | 3S+6NaOH═2Na2S+Na2SO3+3H2O | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
9.下列物质分类正确的是( )
| A. | SO2、CO均为酸性氧化物 | B. | 稀豆浆、氯化铁溶液均为胶体 | ||
| C. | 冰醋酸、四氯化碳均为电解质 | D. | 食醋、氨水均为混合物 |
6.下列反应属于氧化还原反应的是( )
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
7.下列叙述正确的是( )
| A. | 1mol SO42-的质量是96 g | B. | 1mol H2O的质量是18 g/mol | ||
| C. | CO2的摩尔质量是44 g | D. | HCl的相对分子质量是36.5 g/mol |
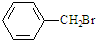
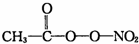 (PAN)等二次污染物.
(PAN)等二次污染物.