题目内容
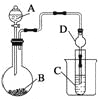
【题目】常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是___________________
(2)验证氯气的氧化性强于碘的实验现象是______________
(3)B中溶液发生反应的离子方程式是______________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
(5)过程Ⅲ实验的目的是______________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增多,______________,得电子能力逐渐减弱,非金属性逐渐减弱
【答案】(1)![]() ;(2)淀粉KI试纸变蓝;(3)Cl2+2Br-=Br2+2Cl-
;(2)淀粉KI试纸变蓝;(3)Cl2+2Br-=Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色
(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰(6)原子半径逐渐增大
【解析】
试题分析:(1)A中产生黄绿色气体为氯气,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2I-=I2+2Cl-,I2能使淀粉变蓝,故答案为:淀粉KI试纸变蓝;
(3)因Cl2的氧化性大于Br2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(4)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,会发生反应:Br2+2I-=I2+2Br-,同时检验产物碘的存在,所以为验证溴的氧化性强于碘,过程Ⅳ的操作和现象为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静置后CCl4层溶液变为紫红色,故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静置后CCl4层溶液变为紫红色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,原子核对最外层电子的引力逐渐减弱,故答案为:原子半径逐渐增大。