题目内容
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200 ℃连续反应24 h,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2的离子方程式为_____________________________________。
(2)用水洗涤时,如何证明SO42—已除尽?________________________________________。
(3)已知1.20 g FeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52 kJ热量,FeS2燃烧反应的热化学方程式为__________________________。
(4)取上述制得的正极材料1.120 0 g(假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.800 0 g红棕色固体,试计算该正极材料中FeS2的质量分数(写出计算过程)。
(1)Fe2++S2O32—+S+H2O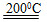 FeS2+2H++SO42—
FeS2+2H++SO42—
(2)取少许最后一次洗涤滤液,先用足量盐酸酸化,再向上述清液中滴加BaCl2溶液,若不出现白色浑浊,表示已洗涤干净
(3)4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) ΔH=-3 408 kJ·mol-1
[或FeS2(s)+ O2(g)=
O2(g)= Fe2O3(s)+2SO2(g)] ΔH=-852 kJ·mol-1
Fe2O3(s)+2SO2(g)] ΔH=-852 kJ·mol-1
(4)解:120n(FeS2)+88n(FeS)=1.120 0
n(FeS2)+n(FeS)=
n(FeS2)=0.007 5 mol
w(FeS2)= ≈0.803 6
≈0.803 6
解析

已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: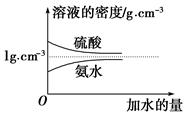
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与
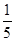 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________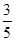 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。 铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )
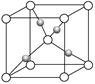
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: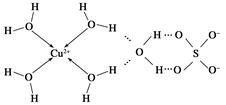
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
Ⅰ.实验室配制1mol/L Na2CO3溶液250ml。
(1)需要固体Na2CO3 g;(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) 。
| A.称量 | B.洗涤 | C.定容 | D.溶解 E.摇匀 F.转移 |
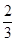 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑; MnFe2O4+xH2↑
MnFe2O4+xH2↑